子宫内膜异位症新药!Myovant口服GnRH受体拮抗剂relugolix显著减少经期/非经期盆腔疼痛!
来源:本站原创 2020-04-24 13:54
relugolix是一种每日一次、口服、促性腺激素释放激素(GnRH)受体拮抗剂,可减少雌二醇和睾酮的生成,开发用于治疗女性的子宫肌瘤和子宫内膜异位症,以及男性的晚期前列腺癌。
2020年04月24日讯 /生物谷BIOON/ --Myovant Sciences是一家专注于开发创新疗法重新定义女性健康和前列腺癌护理的医疗保健公司。近日,该公司宣布,评估relugolix复方片(relugolix 40mg、雌二醇1.0mg、醋酸炔诺酮0.5mg)治疗女性与子宫内膜异位症相关疼痛的SPIRIT项目的首个III期研究达到了共同主要疗效终点和6个关键次要终点。研究中,relugolix复方片的耐受性良好,包括治疗24周期间最小的骨密度丢失。
Myovant还宣布,在一项单独的临床研究中,根据Hoogland Skouby评估量表(得分<5)的评估,在84天治疗期内,relugolix复方片在67例健康女性中达到100%的排卵抑制(得分<5分)。此外,100%的女性在停止治疗后恢复排卵或月经,平均排卵时间为23.5天。
Myovant公司的子宫内膜异位症III期临床项目SPIRIT包括2项跨国、重复的关键临床研究(SPIRIT 1,SPIRIT 2),正在评估relugolix复方片治疗女性子宫内膜异位症相关疼痛的疗效和安全性。研究中,女性患者被随机分成三组,分别接受relugolix复方片(每日一次)治疗24周、relugolix单药(40mg,每日一次)治疗12周+relugolix复方片(每日一次)治疗12周、安慰剂治疗24周。完成2项研究的符合资格女性,有机会参加一项积极治疗扩展研究,该研究中所有女性都接受relugolix复方片治疗,为期80周,总的治疗期可达104周,该研究旨在评估长期治疗的安全性和持续疗效。
在SPIRIT 2研究的共同主要终点分析中,relugolix复方片组有75.2%的女性、安慰剂组有30.4%的女性实现痛经有临床意义的减少(p<0.0001)。对于非月经性骨盆疼痛,relugolix复方片组有66.0%的女性、安慰剂组有42.6%的女性具有临床意义的降低(p<0.0001)。平均而言,在痛经11分(0-10)数字评分量表上,relugolix治疗组女性痛经数值评分降低75.1%,从7.2分(重度疼痛)降低至1.7分(轻度疼痛)。
此外,在第24周测量的6个关键次要终点方面,relugolix复方片与安慰剂相比具有统计学意义,包括:平均痛经和整体骨盆疼痛的变化、疼痛对日常活动的影响(采用子宫内膜异位症健康状况-30[EHP-30]疼痛域测量)、更高比例的女性不使用阿片类药物(全部p<0.0001),非月经性盆腔疼痛(p=0.0012)和性交困难(p=0.0489)。
研究中,relugolix复方片的耐受性良好,24周治疗期内具有最小的骨密度丢失。relugolix复方片组和安慰剂组的不良事件总发生率相似(80.6% vs 75.0%)。relugolix复方片组有5.3%的女性因不良事件停止治疗,而安慰剂组为3.9%。发生在relugolix复方片组至少10%女性患者中的最常见不良事件是头痛、鼻咽炎、潮热。relugolix复方片组有3例妊娠,安慰剂组有5例妊娠。
加州大学旧金山分校(UCSF)著名生殖科学教授、医学博士Linda Giudice表示:“子宫内膜异位症会给许多需要新的适合长期使用的非侵入性治疗方法的女性带来严重的身体疼痛和情绪困扰。今天公布的具有临床意义的结果是非常令人鼓舞的,特别是在疼痛方面取得显著改善的同剂量relugolix复方片也显示了良好的耐受性,包括最小的骨密度丢失。”
Myovant首席执行官Lynn Seely医学博士表示:“在我们成功完成的子宫肌瘤III期研究的基础上,我们对子宫内膜异位症III期研究的积极结果非常满意,这使我们更接近于实现我们的愿景:为患有这些疾病的女性带来一种每日一次、一次一片的药物,这种药物 在临床意义症状缓解和良好耐受安全性之间相平衡的每日一片药物。我们期待着在本季度晚些时候分享我们另一项子宫内膜异位症研究SPIRIT 1的结果。”
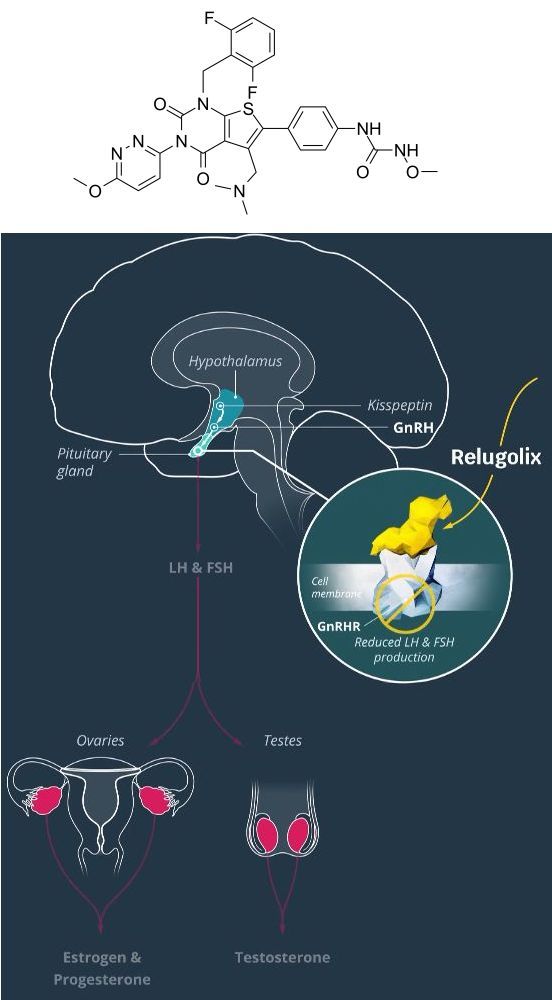
relugolix化学结构式(图片来源:medchemexpress.com)及作用机制
relugolix是一种每日一次、口服、促性腺激素释放激素(GnRH)受体拮抗剂,可通过阻断垂体腺中的GnRH受体,减少卵巢雌二醇的生成,这种激素已知可刺激子宫肌瘤和子宫内膜异位症的生长。此外,relugolix也能抑制睾丸睾酮的生成,这种激素可刺激前列腺癌的生长。
目前,Myovant公司正在开发relugolix复方片治疗子宫肌瘤和子宫内膜异位症。此外,该公司也正在开发relugolix单药片剂(120mg,每日一次)用于治疗晚期前列腺癌。
今年3月,Myovant公司向欧洲药品管理局(EMA)提交了relugolix复方片的营销授权申请(MAA),用于治疗子宫肌瘤女性的中重度症状。该公司计划在今年5月,向美国FDA提交relugolix复方片的新药申请(NDA),用于相同的适应症。子宫肌瘤最常见的2种症状是月经过多(heavy menstrual bleeding,HMB)和疼痛。如果获得批准,relugolix复方片将为子宫肌瘤女性患者提供一种一日一片的治疗方案。就在最近,该公司也向美国FDA提交了relugolix单药片剂(120mg)的新药申请,用于治疗晚期前列腺癌男性患者。在III期HERO研究中,relugolix治疗晚期前列腺癌的缓解率高达96.7%,显著优于醋酸亮丙瑞林。
relugolix由武田研制,Myovant公司(Roivant和武田组建的公司)于2016年6月获得除日本和其他亚洲国家之外的全球独家授权。在日本,relugolix于2019年1月获得批准,以品牌名Relumina上市销售,用于改善子宫肌瘤引起的下列症状:月经过多、下腹痛、腰痛和贫血。
relugolix复方片治疗子宫肌瘤的申请,基于III期LIBERTY项目和一项为期1年的开放标签扩展研究的疗效和安全性数据。LIBERTY项目包括2项跨国、重复关键III期临床研究(LIBERTY 1、LIBERTY 2),入组了伴有月经过多的子宫肌瘤女性患者,评估了relugolix复方片治疗24周。完成2项研究并符合资格的患者有机会入组一项阳性治疗扩展研究,在扩展研究中,所有患者接受为期28周的relugolix复方片治疗,即总的治疗期为52周,目的是评估长期治疗的安全性和疗效。在这52周的总治疗期结束后,符合资格的患者可以选择参加第二个为期52周的随机撤出研究,旨在提供relugolix复方片的2年安全性和疗效数据,并评估维持治疗的必要性。在所有研究中,治疗应答被定义为:采用碱性血红素法测定,在治疗的最后35天期间,月经失血量相对基线减少80毫升、并且较基线降低≥50%。
结果显示,LIBERTY 1和LIBERTY 2研究均达到了主要终点(p<0.0001):(1)在治疗第24周,接受relugolix复方片治疗的患者中有73.4%、71.2%达到应答标准,而接受安慰剂治疗的患者中分别为18.9%、14.7%;(2)平均而言,2项研究中,接受relugolix复方片治疗的患者月经失血量较基线水平平均下降84.3%(p<0.0001)。(3)在治疗第24周,2项研究中,relugolix组和安慰剂组骨密度具有可比性;根据双能X射线吸收测定法(DXA)评估,治疗的24周,relugolix组和安慰剂组的骨密度变化分布(包括异常值)相似。(4)2项研究中,relugolix组合安慰剂组的不良事件总发生率具有可比性。
开放标签研究也达到了主要终点:治疗一年,relugolix组应答率为87.7%,显示了在LIBERTY 1和LIBERTY 2中观察到的应答的持久性。此外,女性患者月经失血量较基线水平平均降低89.9%。每三个月DXA评估一次,治疗一年期间骨密度的变化与LIBERTY 1和LIBERTY 2研究一致。接受relugolix治疗一年的女性患者中,不良事件报告率超过10%,在6个月后报告率超过安慰剂组的不良事件仅为潮红。(生物谷Bioon.com)
原文出处:Myovant Sciences Announces Positive Results from Phase 3 SPIRIT 2 Study Evaluating Once-Daily Relugolix Combination Therapy in Women with Endometriosis and from Ovulation Inhibition Study
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


