2020年3月Cell期刊不得不看的亮点研究
来源:本站原创 2020-03-31 23:16
2020年3月31日讯/生物谷BIOON/---2020年3月份即将结束了,3月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:我国科学家从结构和功能角度揭示SARS-CoV-2利用人ACE2进入细胞机制doi:10.1016/j.cell.2020.03.045病毒感染始于病毒颗粒与宿主表面细胞受体的结合。因此,受体
2020年3月31日讯/生物谷BIOON/---2020年3月份即将结束了,3月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:我国科学家从结构和功能角度揭示SARS-CoV-2利用人ACE2进入细胞机制
doi:10.1016/j.cell.2020.03.045
病毒感染始于病毒颗粒与宿主表面细胞受体的结合。因此,受体识别是病毒的细胞和组织嗜性(tropism)的一个重要决定因素。此外,病毒结合其他物种的相应受体的功能获得也是物种间传播的先决条件。有趣的是,除了HCoV-OC43和HKU1均与糖分子结合从而与细胞附着外,其他的四个人类冠状病毒均将蛋白肽酶识别为受体。HCoV-229E与人氨基肽酶N(hAPN)结合,而MERS-CoV与人二肽基肽酶4(hDPP4或hCD26)相互作用。尽管SARS-CoV和hCoV-NL63属于不同的冠状病毒属,但是它们均与人类血管紧张素转化酶2(hACE2,即人ACE2)相互作用以进入宿主细胞。在COVID-19疫情爆发后,中国科学家迅速确定SARS-CoV-2也利用hACE2进入细胞。
在冠状病毒中,这种进入过程是由嵌入包膜的位于病毒表面的刺突糖蛋白(S蛋白)介导的。在大多数情况下,S蛋白会被宿主蛋白酶切割为分别负责受体识别和膜融合的S1和S2亚基。 S1可以进一步分为N末端结构域(NTD)和C末端结构域(CTD),两者都可以充当受体结合实体(比如,SARS-CoV和MERS-CoV都利用S1 CTD识别受体,因而称为受体结合结构域(RBD),然而小鼠肝炎冠状病毒利用它的S1 NTD与受体结合。在此之前,SARS-CoV-2 S蛋白中负责与hACE2相互作用的区域仍然是未知的。
在一项新的研究中,来自中国科学院、深圳市第三人民医院、山西农业大学、安徽大学、四川大学、中国科技大学和香港大学的研究人员利用免疫染色和流式细胞仪测定技术,首先鉴定出S1 CTD(SARS-CoV-2-CTD)是SARS-CoV-2中与hACE2受体相互作用的关键区域。他们随后解析出SARS-CoV-2-CTD与hACE2结合在一起时的分辨率为2.5 ?的晶体结构,揭示了一种整体上与SARS-CoV RBD(下称SARS-RBD)相类似的受体结合模式。但是,与SARS-RBD相比,SARS-CoV-2-CTD与hACE2形成更多的原子相互作用,这与显示更高的受体结合亲和力的数据相关。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Structural and functional basis of SARS-CoV-2 entry by using human ACE2”。

值得注意的是,一组单克隆抗体(mAb)以及针对SARS-S1/RBD的鼠多克隆抗血清无法与SARS-CoV-2 S蛋白结合,这表明SARS-CoV和SARS-CoV在抗原性上存在显著差异,并且提示着先前开发的基于SARS-RBD的候选疫苗不太可能对SARS-CoV-2预防有任何临床益处。
2.全文编译!复旦大学在Cell期刊上发文,从基因组学角度揭示SARS-CoV-2的起源和出现
doi:10.1016/j.cell.2020.03.035
新型人类冠状病毒SARS-CoV-2(之前称为2019-nCoV)的持续大流行引起了全球的极大关注。我们和中国的其他人参与了对这种病毒的初始基因组测序。在本文中,我们描述了针对SARS-CoV-2的出现,这些基因组数据揭示了什么,并讨论了我们对其起源理解上所存在的差距。
在英国爱丁堡大学Andrew Rambaut博士的帮助下,我们于2020年1月11日(格林威治标准时间, GMT)早些时候在开放存取的virological.org网站(http://virological.org/)上发布了这种病毒的基因组序列。不久之后,中国疾控中心在公众可访问的GISAID数据库(https://www.gisaid.org/)上类似地发布了SARS-CoV-2基因组序列(以及相关的流行病学数据)。在撰写本文时,已有近200个SARS-CoV-2基因组可公开获得,这代表了来自中国及其他地区的这种病毒的基因组多样性,并提供了可自由获取的全球资源。重要的是,SARS-CoV-2基因组序列数据的发布促进了诊断测试和感染性克隆(infectious clone)的快速开发。研发有效疫苗和抗病毒药物的竞赛正在进行中,而且针对抗病毒药物的临床试验正在逐步展开。
尽管SARS-CoV和MERS-CoV与SARS-CoV-2密切相关并且都有蝙蝠宿主,但这两种病毒之间的生物学差异却很明显。如上所述,SARS-CoV-2的传染性明显更高,从而导致与SARS-CoV和MERS-CoV完全不同的流行病学动态。在后两种病毒中,病例数的增长相对较慢,而MERS-CoV从未完全适应人类传播:大多数病例是由于阿拉伯半岛的骆驼溢出造成的,仅零星地发生人与人之间的传播。相比之下,SARS-CoV-2在当地的显著传播最让人吃惊。确定支撑这种传播能力的病毒学特征显然是当务之急。
SARS-CoV-2似乎将不可避免地成为人类中的第五种地方性冠状病毒(其他四种为HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1),并且目前正在完全易感人群中传播。冠状病毒显然具有跨越物种界限并适应新宿主的能力,这使得预测未来会有更多的病毒出现变得很简单,不过尚不清楚为何相比于一些其他的RNA病毒,冠状病毒具有这种能力。至关重要的是,对动物冠状病毒的监视应包括蝙蝠以外的动物,这是因为中间宿主的作用可能非常重要,从而为病毒在人类中的出现提供了更直接的途径。
鉴于野生动物中病毒的多样性以及它们的持续进化,可以说,降低未来疫情爆发风险的最简单最具成本效益的方法是尽可能限制我们对动物病原体的接触。尽管我们与动物世界的亲密关系意味着我们无法建立坚不可摧的屏障,但是针对非法野生动物贸易采取更强有力的行动,以及将所有野生哺乳动物(也许还有禽类)从湿货市场中清除将提供一个重要的缓冲。
3.Cell:重磅!揭示新型冠状病毒SARS-CoV-2进入宿主细胞机制
doi:10.1016/j.cell.2020.02.052
冠状病毒的刺突(S)蛋白(下称S蛋白)有助于病毒进入靶细胞。细胞进入取决于S蛋白的表面亚基S1与细胞受体的结合,这种结合有助于病毒附着至靶细胞的表面。另外,细胞进入需要通过细胞蛋白酶激活S蛋白(S protein priming),这需要在S蛋白的S1/S2和S2'位点切割这种蛋白,并允许病毒膜和细胞膜融合,这一过程由S蛋白的S2亚基驱动。SARS-CoV S蛋白以血管紧张素转换酶2(ACE2)作为进入受体,并利用细胞丝氨酸蛋白酶TMPRSS2激活S蛋白。已在原子水平上阐明了SARS-CoV S/ACE2界面,发现ACE2的使用效率是SARS-CoV传播能力的关键决定因素。SARS-CoV S蛋白和SARS-CoV-2 S蛋白具有大约76%的氨基酸序列一致性(sequence identity)。然而,人们仍不清楚SARS-CoV-2 S蛋白是否像SARS-CoV S蛋白那样使用ACE2和TMPRSS2进入宿主细胞。
在一项新的研究中,德国研究人员提供证据表明SARS-CoV-2的宿主细胞进入依赖于SARS-CoV受体ACE2,并且可以被临床证明的细胞丝氨酸蛋白酶TMPRSS2抑制剂阻断,而且TMPRSS2被SARS-CoV-2用于S蛋白激活。此外,这项研究还发现针对SARS-CoV产生的抗体反应可以至少部分地抵御SARS-CoV-2感染。这些结果对人们对SARS-CoV-2的可传播性和发病机理的理解具有重要意义,并揭示了进行治疗性干预的靶标。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically-proven protease inhibitor”。
这一关于SARS-CoV-2利用S蛋白与ACE2的结合进入宿主细胞的发现也被Zhou和他的同事们报道过(Nature, 2020, doi:10.1038/s41586-020-2012-7),它提示着这种冠状病毒像SARS-CoV那样靶向一系列细胞。在肺部,SARS-CoV主要感染肺细胞和巨噬细胞。然而,ACE2的表达不仅限于肺部,而且还观察到SARS-CoV在ACE2+组织中的肺外扩散。虽然还需要比较SARS-CoV S蛋白和SARS-CoV-2 S蛋白对ACE2的亲和力,但是这些研究人员认为可以预期SARS-CoV-2也会如此。
4.Cell:重磅!揭示新型冠状病毒SARS-CoV-2刺突糖蛋白的结构、功能和抗原性
doi:10.1016/j.cell.2020.02.058
在一项新的研究中,美国华盛顿大学医学院生物化学系的David Veesler博士及其团队报道人ACE2可调节SARS-CoV-2 S蛋白介导的细胞进入,从而确定它是这种新出现的冠状病毒的功能性受体。SARS-CoV-2 S蛋白的结构域B与人ACE2结合的亲和力与来自与2002-2003年SARS疫情相关的SARS-CoV分离株的S蛋白的结构域B相当,这表明SARS-CoV-2 S蛋白的结构域B与人ACE2具有较高的结合亲和力。与人ACE2的紧密结合可以部分解释SARS-CoV-2在人类中的有效传播,就像SARS-CoV的情况一样。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein”。
他们鉴定出在SARS-CoV-2 S蛋白的S1/S2亚基边界存在意料之外的弗林蛋白酶(furin)切割位点,这个位点在S蛋白的生物合成过程中被切割,这种新特征可将这种冠状病毒与SARS-CoV和SARSr-CoV区分开来。正如针对一些高致病性禽流感病毒和致病性新城疫病毒的报道那样,移除这种切割基序会适度影响SARS-CoV-2 S蛋白介导的VeroE6或BHK细胞进入,但是这可能有助于扩大这种冠状病毒的宿主趋向性。
他们解析出SARS-CoV-2 S蛋白胞外结构域三聚体的低温电镜结构,并揭示它具有多个结构域B构象,这使人想起了先前有关SARS-CoV S蛋白和MERS-CoV S蛋白的报道。他们证实SARS-CoV S蛋白小鼠多克隆血清有效抑制SARS-CoV-2 S假病毒进入靶细胞。这些结果为设计可广泛预防SARS-CoV-2、SARS-CoV和SARS-CoV的疫苗铺平了道路。
5.Cell:好狡猾!结核菌产生一种触发咳嗽的分子来促进自身传播
doi:10.1016/j.cell.2020.02.026
在一项新的研究中,来自美国德克萨斯大学的研究人员发现作为一种引起致命性肺部疾病的细菌,结核分枝杆菌(Mycobacterium tuberculosis)似乎通过产生一种触发咳嗽的分子来促进自身传播。这一发现可能导致人们开发出阻止结核病扩散的新方法。相关研究结果近期发表在Cell期刊上,论文标题为“Mycobacterium tuberculosis Sulfolipid-1 Activates Nociceptive Neurons and Induces Cough”。

论文通讯作者Michael Shiloh博士和他的同事们推测作为一种引起结核病的细菌,结核分枝杆菌本身可能产生一种触发气道中神经的物质,它引起结核病患者咳嗽,从而允许这种疾病传播。为了验证这个想法,这些研究人员依靠豚鼠,即一种经常被用来研究结核病和咳嗽的实验室动物。尽管豚鼠已被用作结核分枝杆菌感染的实验模型已有一个多世纪的历史,但尚不清楚这种疾病是否引起这些动物咳嗽。为了解答这个问题,Shiloh和他的同事们将感染了结核分枝杆菌的豚鼠放在特殊的腔室中,记录下由咳嗽引起的压力和体积变化。果然,感染结核分枝杆菌的豚鼠要比未感染的豚鼠咳嗽得多。
在利用来自结核分枝杆菌以及多种其他分枝杆菌的成分开展一系列实验后,Shiloh团队最终鉴定出一种称为硫脂1(sulfolipid-1, SL-1)的分枝杆菌细胞表面脂肪分子是激活实验室中培养的神经元的主要分子。这种激活反应也发生在人类的痛觉神经细胞中,这表明SL-1及其功能已通过在不同哺乳动物物种的进化中得以保存。重要的是,当豚鼠暴露于纯化的SL-1时,它们确实会咳嗽。
为了表明SL-1是咳嗽的罪魁祸首,这些研究人员用经过基因改造后无法产生SL-1的结核分枝杆菌菌株感染豚鼠。这些豚鼠表现出结核病的所有典型症状,但并未出现咳嗽,这导致他们得出结论:SL-1对于在结核分枝杆菌感染期间触发咳嗽至关重要。
6.Cell突破:恢复免疫系统可以支持脑损伤后的修复
doi:10.1016/j.cell.2020.02.013
研究小组使用动物模型来研究受伤后免疫系统如何与脑神经细胞相互作用,以及这如何影响学习和记忆的能力。
昆士兰大学生物医学科学学院和昆士兰脑研究所的研究人员Jana Vukovic博士说,到目前为止,大脑的免疫细胞,即小胶质细胞,被认为是引起炎症的原因,会导致受伤后的认知能力下降。她说:"然而,当我们从老鼠身上移除小胶质细胞时,我们惊讶地发现它们的行为和修复脑组织的能力完全没有变化。"
Vukovic博士的团队随后清除了小神经胶质细胞,让它们重新在大脑中繁殖,发现这大大增加了大脑的修复能力。"恢复活力的小胶质细胞改善了小鼠的学习和记忆,防止了组织损失,刺激了神经元的诞生,"Vukovic博士说。"我们已经表明,小胶质细胞在某种程度上被误解了,我们需要更多地了解它们如何支持和刺激促进修复的途径。"
7.Cell重磅:揭示精子和卵细胞基因组整合的机制
doi:10.1016/j.cell.2020.02.020
精子进入卵子,胚胎发育,最后婴儿出生。那么母亲的半基因组是如何与父亲的半基因组融合形成一个新的人类基因组的呢?事实证明,对于受精过程中这些相对短暂但却至关重要的初始阶段,研究人员并不是很了解。加州大学圣地亚哥医学院的研究人员发现,SPRK1酶在解开精子基因组、剔除特殊包装蛋白、打开父方DNA并进行重大重组方面迈出了第一步--所有这一切都在几小时内完成。这项研究发表在2020年3月12日的《Cell》杂志上。
"在这项研究中,我们只是对回答生命起源的基本问题感兴趣,"加州大学圣地亚哥分校医学院细胞和分子医学系的资深作者Fu Xiangdong博士说。"但在这个过程中,我们发现了一个步骤,可能会对一些人造成障碍,导致一对夫妇的生育困难。现在我们知道SPRK1在这里起作用,它在不孕中的潜在作用可以进一步探索。"
8.Cell:开发出高灵敏检测疾病相关突变的SNIPR技术
doi:10.1016/j.cell.2020.02.011
在一项新研究中,来自美国亚利桑那州立大学等研究机构的研究人员描述了一种检测点突变的新方法。它可以应用于活细胞中,从而提供了一种快速、高度准确和廉价的方法来鉴定与人类健康有关的突变。相关研究结果发表在2020年3月5日的Cell期刊上,论文标题为“Precise and Programmable Detection of Mutations Using Ultraspecific Riboregulators”。论文通讯作者为亚利桑那州立大学的Alexander A. Green博士和Hao Yan博士。
这种方法可与基于试纸的诊断测试(由Green及其同事们开发)结合使用,能够在人体热量驱动的反应中查明突变并显示基于颜色的读数。
Green说,“我们使用我们的技术完成的工作是开发一种新的可移植的方法来检测你想要检测的RNA之间的微小序列差异。有了这种我们称为SNIPR(Single-Nucleotide-Specific Programmable Riboregulator)的系统,我们就有能力根据单个核苷酸差异识别任何RNA序列。”
这种技术非常灵敏,甚至可以检测到表观遗传变化,即对遗传序列的细微化学修饰,可以调节基因表达而无需改变单个碱基的身份。
9.Cell:震惊!研究发现肠道微生物代谢物会增加心血管疾病风险!
doi:10.1016/j.cell.2020.02.016
克利夫兰诊所的研究人员已经确认了一种肠道微生物的副产品--苯乙酰谷氨酰胺(PAG)--与心血管疾病的发展有关,包括心脏病、中风和死亡。这项研究近日发表在《Cell》杂志上。
苯丙氨酸是一种存在于许多食物中的氨基酸,包括以植物和动物为基础的蛋白质来源,如肉类、豆类和大豆。勒纳研究所心血管与代谢科学系主任、米勒家族心脏血管胸科研究所预防心脏病和康复科共同主任Stanley Hazen领导的研究小组发现当苯丙氨酸被肠道内的微生物分解后,它产生的副产品(代谢物)PAG最终会出现在血液中,导致心脏病。
"在过去的十年里,有越来越多的数据表明,肠道微生物在健康中扮演着重要的角色,尤其是在它与心脏病相关的时候," Hazen博士说,他同时也是克利夫兰诊所微生物组和人类健康中心的主任。"我们发现,血液中的PAG会以几种不同的方式增加心血管疾病的风险。"
10.Cell新突破:将受体固定在癌细胞表面,免疫治疗精准打击
doi:10.1016/j.cell.2020.02.019
一种安全可控的体内内吞操作可能具有破坏性的治疗潜力。为此,来自昆士兰大学的研究人员领导的研究小组证明了抗吐剂/抗精神病药丙氯哌嗪可被重新使用,以可逆地抑制治疗性单克隆抗体靶向的膜蛋白的体内内吞作用。
研究人员在人肿瘤体外实验中直接证明了这一点。短暂的抑制内吞可增强靶细胞的可用性,并提高自然杀伤细胞介导的抗体依赖性细胞细胞毒性(ADCC)的效率。ADCC是IgG1抗体诱导的临床反应的介导者,研究人员在这项研究中利用西妥昔单抗、曲妥珠单抗和阿韦单抗进行了证明。
对下游信号通路的广泛分析排除了靶标毒性。通过克服反应性差或耐药肿瘤常见的药物靶点的异质性,临床应用可逆性内吞抑制可显着提高ADCC介导的治疗性抗体的临床疗效。
总的来说,这项研究提出了一种提高治疗性抗体ADCC潜力的策略;表明暂时抑制细胞内吞作用增加了肿瘤细胞抗原的呈递;丙氯哌嗪可用于增强单克隆抗体的抗肿瘤作用;这种方法可能降低肿瘤细胞对多种IgG1抗体反应的异质性。(生物谷 Bioon.com)
1.Cell:我国科学家从结构和功能角度揭示SARS-CoV-2利用人ACE2进入细胞机制
doi:10.1016/j.cell.2020.03.045
病毒感染始于病毒颗粒与宿主表面细胞受体的结合。因此,受体识别是病毒的细胞和组织嗜性(tropism)的一个重要决定因素。此外,病毒结合其他物种的相应受体的功能获得也是物种间传播的先决条件。有趣的是,除了HCoV-OC43和HKU1均与糖分子结合从而与细胞附着外,其他的四个人类冠状病毒均将蛋白肽酶识别为受体。HCoV-229E与人氨基肽酶N(hAPN)结合,而MERS-CoV与人二肽基肽酶4(hDPP4或hCD26)相互作用。尽管SARS-CoV和hCoV-NL63属于不同的冠状病毒属,但是它们均与人类血管紧张素转化酶2(hACE2,即人ACE2)相互作用以进入宿主细胞。在COVID-19疫情爆发后,中国科学家迅速确定SARS-CoV-2也利用hACE2进入细胞。
在冠状病毒中,这种进入过程是由嵌入包膜的位于病毒表面的刺突糖蛋白(S蛋白)介导的。在大多数情况下,S蛋白会被宿主蛋白酶切割为分别负责受体识别和膜融合的S1和S2亚基。 S1可以进一步分为N末端结构域(NTD)和C末端结构域(CTD),两者都可以充当受体结合实体(比如,SARS-CoV和MERS-CoV都利用S1 CTD识别受体,因而称为受体结合结构域(RBD),然而小鼠肝炎冠状病毒利用它的S1 NTD与受体结合。在此之前,SARS-CoV-2 S蛋白中负责与hACE2相互作用的区域仍然是未知的。
在一项新的研究中,来自中国科学院、深圳市第三人民医院、山西农业大学、安徽大学、四川大学、中国科技大学和香港大学的研究人员利用免疫染色和流式细胞仪测定技术,首先鉴定出S1 CTD(SARS-CoV-2-CTD)是SARS-CoV-2中与hACE2受体相互作用的关键区域。他们随后解析出SARS-CoV-2-CTD与hACE2结合在一起时的分辨率为2.5 ?的晶体结构,揭示了一种整体上与SARS-CoV RBD(下称SARS-RBD)相类似的受体结合模式。但是,与SARS-RBD相比,SARS-CoV-2-CTD与hACE2形成更多的原子相互作用,这与显示更高的受体结合亲和力的数据相关。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Structural and functional basis of SARS-CoV-2 entry by using human ACE2”。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.03.045。
值得注意的是,一组单克隆抗体(mAb)以及针对SARS-S1/RBD的鼠多克隆抗血清无法与SARS-CoV-2 S蛋白结合,这表明SARS-CoV和SARS-CoV在抗原性上存在显著差异,并且提示着先前开发的基于SARS-RBD的候选疫苗不太可能对SARS-CoV-2预防有任何临床益处。
2.全文编译!复旦大学在Cell期刊上发文,从基因组学角度揭示SARS-CoV-2的起源和出现
doi:10.1016/j.cell.2020.03.035
新型人类冠状病毒SARS-CoV-2(之前称为2019-nCoV)的持续大流行引起了全球的极大关注。我们和中国的其他人参与了对这种病毒的初始基因组测序。在本文中,我们描述了针对SARS-CoV-2的出现,这些基因组数据揭示了什么,并讨论了我们对其起源理解上所存在的差距。
在英国爱丁堡大学Andrew Rambaut博士的帮助下,我们于2020年1月11日(格林威治标准时间, GMT)早些时候在开放存取的virological.org网站(http://virological.org/)上发布了这种病毒的基因组序列。不久之后,中国疾控中心在公众可访问的GISAID数据库(https://www.gisaid.org/)上类似地发布了SARS-CoV-2基因组序列(以及相关的流行病学数据)。在撰写本文时,已有近200个SARS-CoV-2基因组可公开获得,这代表了来自中国及其他地区的这种病毒的基因组多样性,并提供了可自由获取的全球资源。重要的是,SARS-CoV-2基因组序列数据的发布促进了诊断测试和感染性克隆(infectious clone)的快速开发。研发有效疫苗和抗病毒药物的竞赛正在进行中,而且针对抗病毒药物的临床试验正在逐步展开。
尽管SARS-CoV和MERS-CoV与SARS-CoV-2密切相关并且都有蝙蝠宿主,但这两种病毒之间的生物学差异却很明显。如上所述,SARS-CoV-2的传染性明显更高,从而导致与SARS-CoV和MERS-CoV完全不同的流行病学动态。在后两种病毒中,病例数的增长相对较慢,而MERS-CoV从未完全适应人类传播:大多数病例是由于阿拉伯半岛的骆驼溢出造成的,仅零星地发生人与人之间的传播。相比之下,SARS-CoV-2在当地的显著传播最让人吃惊。确定支撑这种传播能力的病毒学特征显然是当务之急。
SARS-CoV-2似乎将不可避免地成为人类中的第五种地方性冠状病毒(其他四种为HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1),并且目前正在完全易感人群中传播。冠状病毒显然具有跨越物种界限并适应新宿主的能力,这使得预测未来会有更多的病毒出现变得很简单,不过尚不清楚为何相比于一些其他的RNA病毒,冠状病毒具有这种能力。至关重要的是,对动物冠状病毒的监视应包括蝙蝠以外的动物,这是因为中间宿主的作用可能非常重要,从而为病毒在人类中的出现提供了更直接的途径。
鉴于野生动物中病毒的多样性以及它们的持续进化,可以说,降低未来疫情爆发风险的最简单最具成本效益的方法是尽可能限制我们对动物病原体的接触。尽管我们与动物世界的亲密关系意味着我们无法建立坚不可摧的屏障,但是针对非法野生动物贸易采取更强有力的行动,以及将所有野生哺乳动物(也许还有禽类)从湿货市场中清除将提供一个重要的缓冲。
3.Cell:重磅!揭示新型冠状病毒SARS-CoV-2进入宿主细胞机制
doi:10.1016/j.cell.2020.02.052
冠状病毒的刺突(S)蛋白(下称S蛋白)有助于病毒进入靶细胞。细胞进入取决于S蛋白的表面亚基S1与细胞受体的结合,这种结合有助于病毒附着至靶细胞的表面。另外,细胞进入需要通过细胞蛋白酶激活S蛋白(S protein priming),这需要在S蛋白的S1/S2和S2'位点切割这种蛋白,并允许病毒膜和细胞膜融合,这一过程由S蛋白的S2亚基驱动。SARS-CoV S蛋白以血管紧张素转换酶2(ACE2)作为进入受体,并利用细胞丝氨酸蛋白酶TMPRSS2激活S蛋白。已在原子水平上阐明了SARS-CoV S/ACE2界面,发现ACE2的使用效率是SARS-CoV传播能力的关键决定因素。SARS-CoV S蛋白和SARS-CoV-2 S蛋白具有大约76%的氨基酸序列一致性(sequence identity)。然而,人们仍不清楚SARS-CoV-2 S蛋白是否像SARS-CoV S蛋白那样使用ACE2和TMPRSS2进入宿主细胞。
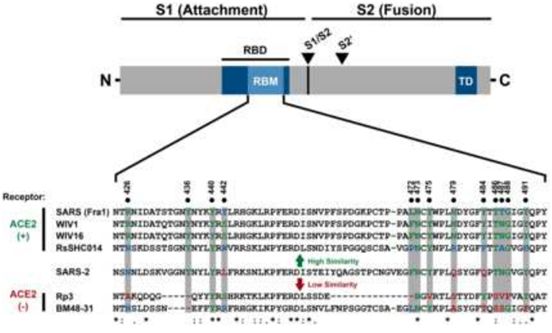
在一项新的研究中,德国研究人员提供证据表明SARS-CoV-2的宿主细胞进入依赖于SARS-CoV受体ACE2,并且可以被临床证明的细胞丝氨酸蛋白酶TMPRSS2抑制剂阻断,而且TMPRSS2被SARS-CoV-2用于S蛋白激活。此外,这项研究还发现针对SARS-CoV产生的抗体反应可以至少部分地抵御SARS-CoV-2感染。这些结果对人们对SARS-CoV-2的可传播性和发病机理的理解具有重要意义,并揭示了进行治疗性干预的靶标。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically-proven protease inhibitor”。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.02.052。
这一关于SARS-CoV-2利用S蛋白与ACE2的结合进入宿主细胞的发现也被Zhou和他的同事们报道过(Nature, 2020, doi:10.1038/s41586-020-2012-7),它提示着这种冠状病毒像SARS-CoV那样靶向一系列细胞。在肺部,SARS-CoV主要感染肺细胞和巨噬细胞。然而,ACE2的表达不仅限于肺部,而且还观察到SARS-CoV在ACE2+组织中的肺外扩散。虽然还需要比较SARS-CoV S蛋白和SARS-CoV-2 S蛋白对ACE2的亲和力,但是这些研究人员认为可以预期SARS-CoV-2也会如此。
4.Cell:重磅!揭示新型冠状病毒SARS-CoV-2刺突糖蛋白的结构、功能和抗原性
doi:10.1016/j.cell.2020.02.058
在一项新的研究中,美国华盛顿大学医学院生物化学系的David Veesler博士及其团队报道人ACE2可调节SARS-CoV-2 S蛋白介导的细胞进入,从而确定它是这种新出现的冠状病毒的功能性受体。SARS-CoV-2 S蛋白的结构域B与人ACE2结合的亲和力与来自与2002-2003年SARS疫情相关的SARS-CoV分离株的S蛋白的结构域B相当,这表明SARS-CoV-2 S蛋白的结构域B与人ACE2具有较高的结合亲和力。与人ACE2的紧密结合可以部分解释SARS-CoV-2在人类中的有效传播,就像SARS-CoV的情况一样。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein”。
他们鉴定出在SARS-CoV-2 S蛋白的S1/S2亚基边界存在意料之外的弗林蛋白酶(furin)切割位点,这个位点在S蛋白的生物合成过程中被切割,这种新特征可将这种冠状病毒与SARS-CoV和SARSr-CoV区分开来。正如针对一些高致病性禽流感病毒和致病性新城疫病毒的报道那样,移除这种切割基序会适度影响SARS-CoV-2 S蛋白介导的VeroE6或BHK细胞进入,但是这可能有助于扩大这种冠状病毒的宿主趋向性。
他们解析出SARS-CoV-2 S蛋白胞外结构域三聚体的低温电镜结构,并揭示它具有多个结构域B构象,这使人想起了先前有关SARS-CoV S蛋白和MERS-CoV S蛋白的报道。他们证实SARS-CoV S蛋白小鼠多克隆血清有效抑制SARS-CoV-2 S假病毒进入靶细胞。这些结果为设计可广泛预防SARS-CoV-2、SARS-CoV和SARS-CoV的疫苗铺平了道路。
5.Cell:好狡猾!结核菌产生一种触发咳嗽的分子来促进自身传播
doi:10.1016/j.cell.2020.02.026
在一项新的研究中,来自美国德克萨斯大学的研究人员发现作为一种引起致命性肺部疾病的细菌,结核分枝杆菌(Mycobacterium tuberculosis)似乎通过产生一种触发咳嗽的分子来促进自身传播。这一发现可能导致人们开发出阻止结核病扩散的新方法。相关研究结果近期发表在Cell期刊上,论文标题为“Mycobacterium tuberculosis Sulfolipid-1 Activates Nociceptive Neurons and Induces Cough”。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.02.026。
论文通讯作者Michael Shiloh博士和他的同事们推测作为一种引起结核病的细菌,结核分枝杆菌本身可能产生一种触发气道中神经的物质,它引起结核病患者咳嗽,从而允许这种疾病传播。为了验证这个想法,这些研究人员依靠豚鼠,即一种经常被用来研究结核病和咳嗽的实验室动物。尽管豚鼠已被用作结核分枝杆菌感染的实验模型已有一个多世纪的历史,但尚不清楚这种疾病是否引起这些动物咳嗽。为了解答这个问题,Shiloh和他的同事们将感染了结核分枝杆菌的豚鼠放在特殊的腔室中,记录下由咳嗽引起的压力和体积变化。果然,感染结核分枝杆菌的豚鼠要比未感染的豚鼠咳嗽得多。
在利用来自结核分枝杆菌以及多种其他分枝杆菌的成分开展一系列实验后,Shiloh团队最终鉴定出一种称为硫脂1(sulfolipid-1, SL-1)的分枝杆菌细胞表面脂肪分子是激活实验室中培养的神经元的主要分子。这种激活反应也发生在人类的痛觉神经细胞中,这表明SL-1及其功能已通过在不同哺乳动物物种的进化中得以保存。重要的是,当豚鼠暴露于纯化的SL-1时,它们确实会咳嗽。
为了表明SL-1是咳嗽的罪魁祸首,这些研究人员用经过基因改造后无法产生SL-1的结核分枝杆菌菌株感染豚鼠。这些豚鼠表现出结核病的所有典型症状,但并未出现咳嗽,这导致他们得出结论:SL-1对于在结核分枝杆菌感染期间触发咳嗽至关重要。
6.Cell突破:恢复免疫系统可以支持脑损伤后的修复
doi:10.1016/j.cell.2020.02.013
研究小组使用动物模型来研究受伤后免疫系统如何与脑神经细胞相互作用,以及这如何影响学习和记忆的能力。
昆士兰大学生物医学科学学院和昆士兰脑研究所的研究人员Jana Vukovic博士说,到目前为止,大脑的免疫细胞,即小胶质细胞,被认为是引起炎症的原因,会导致受伤后的认知能力下降。她说:"然而,当我们从老鼠身上移除小胶质细胞时,我们惊讶地发现它们的行为和修复脑组织的能力完全没有变化。"
Vukovic博士的团队随后清除了小神经胶质细胞,让它们重新在大脑中繁殖,发现这大大增加了大脑的修复能力。"恢复活力的小胶质细胞改善了小鼠的学习和记忆,防止了组织损失,刺激了神经元的诞生,"Vukovic博士说。"我们已经表明,小胶质细胞在某种程度上被误解了,我们需要更多地了解它们如何支持和刺激促进修复的途径。"
7.Cell重磅:揭示精子和卵细胞基因组整合的机制
doi:10.1016/j.cell.2020.02.020
精子进入卵子,胚胎发育,最后婴儿出生。那么母亲的半基因组是如何与父亲的半基因组融合形成一个新的人类基因组的呢?事实证明,对于受精过程中这些相对短暂但却至关重要的初始阶段,研究人员并不是很了解。加州大学圣地亚哥医学院的研究人员发现,SPRK1酶在解开精子基因组、剔除特殊包装蛋白、打开父方DNA并进行重大重组方面迈出了第一步--所有这一切都在几小时内完成。这项研究发表在2020年3月12日的《Cell》杂志上。
"在这项研究中,我们只是对回答生命起源的基本问题感兴趣,"加州大学圣地亚哥分校医学院细胞和分子医学系的资深作者Fu Xiangdong博士说。"但在这个过程中,我们发现了一个步骤,可能会对一些人造成障碍,导致一对夫妇的生育困难。现在我们知道SPRK1在这里起作用,它在不孕中的潜在作用可以进一步探索。"
8.Cell:开发出高灵敏检测疾病相关突变的SNIPR技术
doi:10.1016/j.cell.2020.02.011
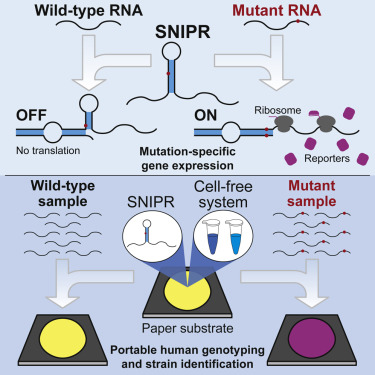
在一项新研究中,来自美国亚利桑那州立大学等研究机构的研究人员描述了一种检测点突变的新方法。它可以应用于活细胞中,从而提供了一种快速、高度准确和廉价的方法来鉴定与人类健康有关的突变。相关研究结果发表在2020年3月5日的Cell期刊上,论文标题为“Precise and Programmable Detection of Mutations Using Ultraspecific Riboregulators”。论文通讯作者为亚利桑那州立大学的Alexander A. Green博士和Hao Yan博士。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.02.011。
这种方法可与基于试纸的诊断测试(由Green及其同事们开发)结合使用,能够在人体热量驱动的反应中查明突变并显示基于颜色的读数。
Green说,“我们使用我们的技术完成的工作是开发一种新的可移植的方法来检测你想要检测的RNA之间的微小序列差异。有了这种我们称为SNIPR(Single-Nucleotide-Specific Programmable Riboregulator)的系统,我们就有能力根据单个核苷酸差异识别任何RNA序列。”
这种技术非常灵敏,甚至可以检测到表观遗传变化,即对遗传序列的细微化学修饰,可以调节基因表达而无需改变单个碱基的身份。
9.Cell:震惊!研究发现肠道微生物代谢物会增加心血管疾病风险!
doi:10.1016/j.cell.2020.02.016
克利夫兰诊所的研究人员已经确认了一种肠道微生物的副产品--苯乙酰谷氨酰胺(PAG)--与心血管疾病的发展有关,包括心脏病、中风和死亡。这项研究近日发表在《Cell》杂志上。
苯丙氨酸是一种存在于许多食物中的氨基酸,包括以植物和动物为基础的蛋白质来源,如肉类、豆类和大豆。勒纳研究所心血管与代谢科学系主任、米勒家族心脏血管胸科研究所预防心脏病和康复科共同主任Stanley Hazen领导的研究小组发现当苯丙氨酸被肠道内的微生物分解后,它产生的副产品(代谢物)PAG最终会出现在血液中,导致心脏病。
"在过去的十年里,有越来越多的数据表明,肠道微生物在健康中扮演着重要的角色,尤其是在它与心脏病相关的时候," Hazen博士说,他同时也是克利夫兰诊所微生物组和人类健康中心的主任。"我们发现,血液中的PAG会以几种不同的方式增加心血管疾病的风险。"
10.Cell新突破:将受体固定在癌细胞表面,免疫治疗精准打击
doi:10.1016/j.cell.2020.02.019
一种安全可控的体内内吞操作可能具有破坏性的治疗潜力。为此,来自昆士兰大学的研究人员领导的研究小组证明了抗吐剂/抗精神病药丙氯哌嗪可被重新使用,以可逆地抑制治疗性单克隆抗体靶向的膜蛋白的体内内吞作用。
研究人员在人肿瘤体外实验中直接证明了这一点。短暂的抑制内吞可增强靶细胞的可用性,并提高自然杀伤细胞介导的抗体依赖性细胞细胞毒性(ADCC)的效率。ADCC是IgG1抗体诱导的临床反应的介导者,研究人员在这项研究中利用西妥昔单抗、曲妥珠单抗和阿韦单抗进行了证明。
对下游信号通路的广泛分析排除了靶标毒性。通过克服反应性差或耐药肿瘤常见的药物靶点的异质性,临床应用可逆性内吞抑制可显着提高ADCC介导的治疗性抗体的临床疗效。
总的来说,这项研究提出了一种提高治疗性抗体ADCC潜力的策略;表明暂时抑制细胞内吞作用增加了肿瘤细胞抗原的呈递;丙氯哌嗪可用于增强单克隆抗体的抗肿瘤作用;这种方法可能降低肿瘤细胞对多种IgG1抗体反应的异质性。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


