深度解读!新型冠状病毒或存在两种亚型 其中一种亚型更具侵袭性传染力更强
来源:本站原创 2020-03-06 18:24
2020年3月5日 讯 /生物谷BIOON/ --新型冠状病毒(SARS-CoV-2)引起的肺炎于2019年12月下旬开始在中国武汉流行,从那时开始,SARS-CoV-2就已经开始影响中国的大部分地区,同时也引起了全球的广泛关注。截至2020年2月28日,中国确诊患者人数达到78,959例,同时有2791例患者死亡。此前有研究表明,SARS-CoV-2与蝙蝠
2020年3月5日 讯 /生物谷BIOON/ --新型冠状病毒(SARS-CoV-2)引起的肺炎于2019年12月下旬开始在中国武汉流行,从那时开始,SARS-CoV-2就已经开始影响中国的大部分地区,同时也引起了全球的广泛关注。截至2020年2月28日,中国确诊患者人数达到78,959例,同时有2791例患者死亡。此前有研究表明,SARS-CoV-2与蝙蝠携带的SARS冠状病毒(RaTG13)之间在基因组上相似度高达96.2%,而且SARS-CoV-2与穿山甲所携带的冠状病毒在进入宿主细胞与关键的刺突蛋白受体结合结构域结合模式上几乎是一样的。
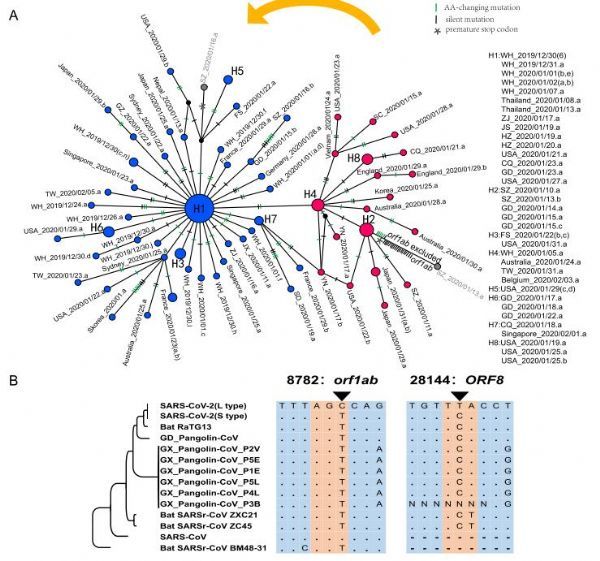
SARS-CoV-2病毒的单倍型分析
图片来源:Xiaolu Tang,et al. National Science Review,doi:10.1093/nsr/nwaa036
疫情进展到现在,很多人不禁都会担心新型冠状病毒是否已经发生突变,其突变后毒力是否会变得更强,这也是当前全球科学家们研究的重点之一;近日,一篇发表在中国科学院主办的杂志National Science Review上题为“On the origin and continuing evolution of SARS-CoV-2”的研究报告中,来自北京大学和中国科学院上海巴斯德研究所等机构的科学家们通过研究对SARS-CoV-2进行了迄今为止最大规模的全基因组分子进化分析,他们发现,SARS-CoV-2目前已经进化出L和S两个亚型,L亚型(70%)较S亚型(30%)更为普遍,且这两种病毒亚型在地域分布及人群中的比例相差较大,研究人员推测,这两种亚型的传播能力、致病性或许也存在较大区别。
这项研究中,研究人员调查了SARS-CoV-2与其它相关冠状病毒之间的分子进化差异,尽管基因组分析结果表明SARS-CoV-2更接近于冠状病毒RaTG13,但其二者在中性位点上的差异要远高于此前研究者的认识;本文中,研究者深入追踪了SARS-CoV-2的中间自然宿主,通过对103个SARS-CoV-2毒株的基因组进行群体遗传性分析,研究者发现,SARS-CoV-2已经进化成了两个主要的亚型,即L型和S型,尽管L型相比S型更为普遍,且进化分析表明S型更有可能是SARS-CoV-2更古老的“版本”,研究人员认为,L型要比S型更具侵袭性且传播能力更强。在103个SARS-CoV-2毒株中,其中101个毒株表现出了两个SNPs(单核苷酸多态性)之间的完全连锁特性,72株表现为“CT”单倍型(L型,T28,144位点位于亮氨酸(Leucine)密码子中),29株表现为“TC”单倍型(S型,因为C28,144位点位于丝氨酸(Serine)密码子中)。
由于非同义位点通常要比同义位点具有更强的负向选择特性,因此在不分离两类位点的情况下计算序列的差异性或许就会低估分子进化差异的程度;尽管SARS-CoV-2与RaTG13之间在总核苷酸上仅相差大约4%的比例,但这两种病毒之间的基因组平均dS值(通常是一种中性代表)却为0.17;值得注意的是,人类和黑猩猩之间的全基因组dS值为0.012,因此SARS-CoV-2与RaTG13之间的中性分子分散差异(遗传距离)相当于人类和黑猩猩之间区别的14倍,相当于人类和猕猴之间的2倍;研究者表示,SARS-CoV-2和GD-穿山甲-CoV之间的基因组平均dS值为0.475,人类和小鼠之间为0.5,而SARS-CoV-2和GX穿山甲-CoV之间的dS值甚至更大,为0.722,他们认为,在追踪SARS-CoV-2的起源和自然中间宿主时,我们或许应该考虑到中性进化位点的差异而不是所有核苷酸序列的差异。
当研究者进行分子进化和群体遗传学研究分析后他们发现,在SARS-CoV-2和其它相关病毒进化的过程中,某些氨基酸的改变或许会受到自然选择的影响,然而,负选择似乎是作用于这些病毒的主要力量,有意思的是,研究人员从深圳一名患者(SZ_2020/01/13.a, GISAID ID: EPI_ISL_406592)机体中分离到的SARS-CoV-2在基因组8782和28144位点上均含有C碱基,其既不属于L型也不属于S型,值得注意的是,该菌株在orf1ab基因上存在一个终止增益突变,当其从祖辈单体型分化后会积累20个沉默突变和5个非同义突变,因此,该菌株orf1ab基因的破坏或许削弱了基因组序列的功能约束能力。研究人员从居住在韩国的患者(Skorea_2020/01.a, GISAID: EPI_ISL_411929)机体中分离到的病毒获得了6个与SARS-CoV-2最常见的祖先不同的非同义突变,即orf1ab(M902I和T6891M), S (S221W), ORF3a (W128L和G251V)和E (L37H)。如果这些氨基酸位点的改变并非测序错误导致,那么研究人员就能通过研究来分析这些突变是否会影响SARS-CoV-2的传播和发病机制。
研究者认为,S型是祖先的(更古老),而L型则是由S型演变而来,有趣的是,通过位于8782 (orf1ab: T8517C,同义位点)和28144(ORF8: C251T, S84L)两个位置紧密连接的SNPs就能够清晰地定义S型和L型,然而目前研究人员并不清楚在人类或中间宿主机体中L型是否是从S型进化而来,以及是否L型要比S型更具侵袭性。编码复制转录酶的orf1ab基因对于病毒基因组的复制和病毒的毒力至关重要,尽管该基因T8517C位点的突变并不会改变蛋白质的序列(其会将密码子AGT(丝氨酸)改变为AGC(还是丝氨酸)),于是研究者推测,该突变可能会影响orf1ab基因的翻译,因为其会首选AGT密码子而不是AGC密码子。ORF8则会促进ATF6基因的表达,ATF6是人类细胞中内质网的展开蛋白反应因子,为此,研究人员非常感兴趣揭示ORF8中S84L AA的功能,以及在SARS-CoV-2致病过程中这两种突变所产生的组合性效应。
最后研究者总结道,当他们对103个SARS-CoV-2毒株的基因组进行测序后发现,L型病毒或许并S型更具侵袭性且更易传播扩散;当SARS-CoV-2爆发后,人为的干预或许改变了L型和S型病毒的相对丰度,目前本文研究所分析的数据仍然非常有限,后期研究者还需要对大量数据进行更为深入的分析来更好地理解SARS-CoV-2的进化和流行病学机制;目前研究者们迫切需要将基因组学数据、流行病学数据和临床患者的症状图表记录等数据进行整合,进一步进行更为全面的研究。(生物谷Bioon.com)
参考资料:
Xiaolu Tang,Changcheng Wu, Xiang Li, et al. On the origin and continuing evolution of SARS-CoV-2, National Science Review,03 March 2020, doi:10.1093/nsr/nwaa036
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。