FDA接受辉瑞/礼来潜在“first-in-class”止痛药上市申请
来源:药明康德 2020-03-04 12:19
日前,辉瑞(Pfizer)和礼来(Eli Lilly and Company)公司联合宣布,美国FDA接受其皮下注射止痛药tanezumab的生物制品许可申请(BLA),治疗因中重度骨关节炎(OA)而引起慢性疼痛的患者。Tanezumab是一款人源化的神经生长因子(NGF)单克隆抗体。由于骨骼两端具有保护功能的软骨磨损而导致的OA,是一种进展型的
日前,辉瑞(Pfizer)和礼来(Eli Lilly and Company)公司联合宣布,美国FDA接受其皮下注射止痛药tanezumab的生物制品许可申请(BLA),治疗因中重度骨关节炎(OA)而引起慢性疼痛的患者。Tanezumab是一款人源化的神经生长因子(NGF)单克隆抗体。
由于骨骼两端具有保护功能的软骨磨损而导致的OA,是一种进展型的关节疾病。OA最主要的症状之一是慢性疼痛,可能在关节运动时或运动后发生,同时也会限制患者的运动能力。在美国,OA影响了大约2700万人,其中1100万为中重度OA患者。这些OA患者急需一款安全的新型疗法来帮助他们管理疼痛。
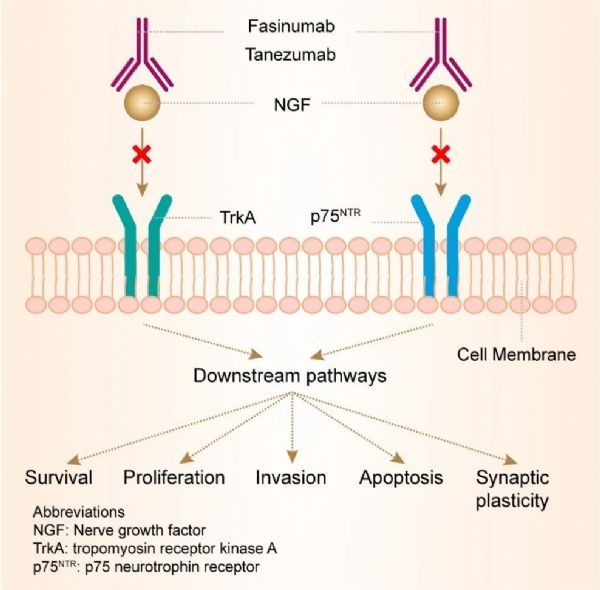
Tanezumab是一款人源化神经生长因子单克隆抗体,也是首款得到FDA快速通道资格的NGF抑制剂,它具有可以选择性结合并抑制NGF的功能。在人体出现因受伤、炎症引起的疼痛或慢性疼痛时,NGF的水平也会相应上升。因此,通过选择性抑制NGF,tanezumab可能有助于阻断肌肉、皮肤和器官产生的疼痛信号进入脊髓和大脑。
由于tanezumab这一新作用机制与阿片类药物和包括非甾体类抗炎药(NSAIDs)在内的其它镇痛药完全不同,在至今为止的试验中从未出现过任何成瘾、滥用或依赖的风险。Tanezumab的研究目前主要针对OA疼痛、重度慢性腰疼(CLBP)以及由于癌症骨转移引起的疼痛这三类疼痛的治疗。
该项BLA的递交是基于39项1至3期临床试验的积极数据,这些试验评估了tanezumab在治疗18000例患者中的疗效与安全性,其中包括3项评估中重度OA患者的3期试验。在其中一项为期24周的3期临床研究中,tanezumab达到了试验的所有主要终点,它的治疗使膝关节或髋关节中重度OA疼痛患者感受的疼痛和身体功能达到统计学意义上的显着改善。在另一项为期16周的3期临床研究中,超过一半患者的疼痛程度获得了50%及以上的减轻。
“FDA接受tanezumab的上市申请是一项重要的里程碑,”辉瑞全球产品开发团队负责人Ken Verburg博士说:“近十多年来,没有治疗这种使人衰弱的OA疗法出现。因此,这些患者迫切需要创新疗法出现。其它止痛药对中重度OA导致的慢性疼痛的治疗没有使患者达到很好的缓解。如果获得批准,tanezumab将成为治疗这些患者的first-in-class疗法。”
“OA患者面临巨大的身体疼痛负担,几乎在生活的每个方面都受到影响。这种疼痛会影响他们参与日常活动的能力,同时对患者心理也产生重大影响,”礼来生物医学总裁Patrik Jonsson先生说:“我们期待与FDA紧密合作,将tanezumab尽快带给中重度OA患者。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。