两篇Nature揭示胆汁酸在调节肠道免疫和肠道炎症中起关键作用
来源:本站原创 2020-01-13 15:25
2020年1月13日讯/生物谷BIOON/---胆汁是由肝脏和胆囊产生的汁液。胆汁中的胆汁酸能够溶解脂肪,它们还可能在免疫反应和炎症中起作用吗?根据美国哈佛医学院开展的两项独立的研究,答案似乎是肯定的。这两项以小鼠为实验对象的研究发现胆汁酸可促进几种参与调节炎症并且与肠道炎症性疾病相关的几种类型的T细胞的分化和活性。它们还揭示肠道微生物对于将胆汁酸转化为免疫
2020年1月13日讯/生物谷BIOON/---胆汁是由肝脏和胆囊产生的汁液。胆汁中的胆汁酸能够溶解脂肪,它们还可能在免疫反应和炎症中起作用吗?根据美国哈佛医学院开展的两项独立的研究,答案似乎是肯定的。
这两项以小鼠为实验对象的研究发现胆汁酸可促进参与调节炎症并且与肠道炎症性疾病相关的几种类型的T细胞的分化和活性。它们还揭示肠道微生物对于将胆汁酸转化为免疫信号分子至关重要。这就为调节肠道炎症提供了一种潜在的治疗途径,其中肠道炎症可导致诸如炎症性肠病(IBD)之类的自身免疫性疾病产生。
在第一项研究中,哈佛医学院免疫学家Jun Huh及其团队揭示出胆汁酸通过与肠道中的免疫细胞相互作用来发挥它们的免疫调节作用。一旦胆汁酸离开胆囊并完成它们的脂肪溶解作用,它们就会通过消化道,在那里肠道细菌将它们修饰成免疫调节分子。这些经过修饰的胆汁酸随后激活两类免疫细胞:调节性T细胞(Treg)和效应辅助性T细胞(特别是Th17),这两类免疫细胞各自通过抑制或促进炎症来调节免疫反应。相关研究结果近期发表在Nature期刊上,论文标题为“Bile acid metabolites control TH17 and Treg cell differentiation”。
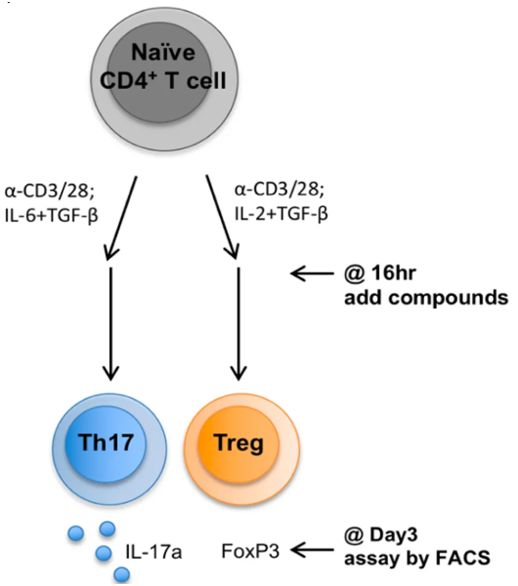
在正常情况下,促炎性Th17细胞和抗炎性Treg细胞的水平相互保持平衡,从而在不引起过多破坏组织的炎症的情况下,对病原体维持一定程度的抵抗。这些细胞在肠道感染中起关键作用。Th17细胞会引发炎症来抑制肠道感染,一旦威胁消除后,Treg细胞就会抑制炎症。如果不加以限制,Th17细胞的活性还可以导致异常炎症,从而促进自身免疫性疾病并损害肠道。
在实验中,Huh团队使用了未分化的小鼠T细胞(即初始小鼠T细胞),并且一次性让它们暴露于多种胆汁酸代谢产物中。这些实验表明两种不同的胆汁酸代谢产物对T细胞产生不同的作用---一种代谢产物促进Treg细胞分化,而另一种代谢产物抑制Th17细胞分化。当Huh团队将这两种胆汁酸代谢产物中的每种施用于小鼠时,他们观察到它们的Th17和Treg细胞相应地下降和上升。此外,他们还发现人类粪便(包括IBD患者的粪便)中也存在这两种胆汁酸副产物。
Huh补充道,“我们的发现鉴定出肠道免疫的一种重要的调节机制:肠道中的微生物可以修饰胆汁酸并将它们转变为炎症调节物。”
如果在进一步的研究中得到证实,那么这些结果可能有助于人们开发靶向Treg和Th17细胞的小分子药物来控制炎症并治疗影响肠道的自身免疫性疾病。
在第二项研究中,哈佛医学院布拉瓦尼克研究所免疫学教授Dennis Kasper及其研究团队着重研究了由于暴露于肠道微生物而结肠中产生的一个抑制炎症的Treg细胞亚群(称为结肠Treg细胞)。相反而言,大多数其他的免疫细胞起源于胸腺。相关研究结果近期发表在Nature期刊上,论文标题为“Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis”。
较低的结肠Treg细胞水平与诸如IBD和克罗恩病之类的自身免疫性疾病产生相关。
Kasper的实验表明肠道微生物和饮食可以协同作用来修饰胆汁酸,进而影响小鼠中的结肠Treg细胞水平。他们还发现由于缺乏胆汁酸或胆汁酸传感蛋白而诱导的结肠Treg细胞水平低下,使得小鼠容易患上炎症性结肠炎(inflammatory colitis),即一种类似于人IBD的疾病。
为了验证肠道细菌将对因摄入食物而产生的食源性胆汁酸转化为免疫信号分子的假设,Kasper团队沉默了多种肠道细菌中的胆汁酸转化基因,然后将经过基因修饰和未经过基因修饰的肠道细菌定植到经专门培育而使得肠道无菌的小鼠体内。肠道中接受缺乏胆汁酸转化基因的肠道细菌定植的小鼠具有明显下降的结肠Treg细胞水平。他们随后给这些小鼠喂食营养丰富的食物或最低限度食物(minimal food,即维持生命所需的最低限度食物)。
相比于摄入营养丰富的食物,携带正常肠道微生物的小鼠在摄入最低限度食物后具有更低的结肠Treg细胞水平和胆汁酸水平。但是,肠道无菌的小鼠在摄入营养丰富的食物后也具有较低的Treg细胞水平---这一发现表明肠道微生物和食源性胆汁酸都是调节免疫细胞水平所必需的。
为了测试胆汁酸是否直接参与免疫细胞调节,Kasper团队随后将各种胆汁酸分子与具有较低Treg细胞水平且摄入最低限度食物的小鼠的饮用水混合。几周之后,这些小鼠体内的抑制炎症的Treg细胞水平增加了。
在最后一步,Kasper团队给予三组小鼠一种诱导结肠炎的化合物。第一组小鼠接受摄入未添加胆汁酸分子的最低限度食物,第二组小鼠摄入营养丰富的食物,第三组小鼠摄入最低限度食物并喝添加着胆汁酸分子的饮用水。正如预期的那样,仅那些摄入未添加胆汁酸分子的最低限度食物的小鼠患上结肠炎。这就证实胆汁酸在Treg细胞调节、肠道炎症和结肠炎风险中起关键作用。
Kasper,“我们的研究结果证实肠道微生物、胆汁酸和免疫系统之间存在着优雅的三方相互作用。重要的是,我们的研究提示着考虑利用某些肠道细菌作为调节疾病风险的方法是合理的。”(生物谷 Bioon.com)
参考资料:
1.Saiyu Hang et al. Bile acid metabolites control TH17 and Treg cell differentiation. Nature, 2019, doi:10.1038/s41586-019-1785-z.
2.Xinyang Song et al. Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis. Nature, 2019, doi:10.1038/s41586-019-1865-0.
3.Fat-dissolving bile acids may help regulate gut immunity and inflammation
https://medicalxpress.com/news/2020-01-fat-dissolving-bile-acids-gut-immunity.html
这两项以小鼠为实验对象的研究发现胆汁酸可促进参与调节炎症并且与肠道炎症性疾病相关的几种类型的T细胞的分化和活性。它们还揭示肠道微生物对于将胆汁酸转化为免疫信号分子至关重要。这就为调节肠道炎症提供了一种潜在的治疗途径,其中肠道炎症可导致诸如炎症性肠病(IBD)之类的自身免疫性疾病产生。
在第一项研究中,哈佛医学院免疫学家Jun Huh及其团队揭示出胆汁酸通过与肠道中的免疫细胞相互作用来发挥它们的免疫调节作用。一旦胆汁酸离开胆囊并完成它们的脂肪溶解作用,它们就会通过消化道,在那里肠道细菌将它们修饰成免疫调节分子。这些经过修饰的胆汁酸随后激活两类免疫细胞:调节性T细胞(Treg)和效应辅助性T细胞(特别是Th17),这两类免疫细胞各自通过抑制或促进炎症来调节免疫反应。相关研究结果近期发表在Nature期刊上,论文标题为“Bile acid metabolites control TH17 and Treg cell differentiation”。

图片来自Nature, 2019, doi:10.1038/s41586-019-1785-z。
在正常情况下,促炎性Th17细胞和抗炎性Treg细胞的水平相互保持平衡,从而在不引起过多破坏组织的炎症的情况下,对病原体维持一定程度的抵抗。这些细胞在肠道感染中起关键作用。Th17细胞会引发炎症来抑制肠道感染,一旦威胁消除后,Treg细胞就会抑制炎症。如果不加以限制,Th17细胞的活性还可以导致异常炎症,从而促进自身免疫性疾病并损害肠道。
在实验中,Huh团队使用了未分化的小鼠T细胞(即初始小鼠T细胞),并且一次性让它们暴露于多种胆汁酸代谢产物中。这些实验表明两种不同的胆汁酸代谢产物对T细胞产生不同的作用---一种代谢产物促进Treg细胞分化,而另一种代谢产物抑制Th17细胞分化。当Huh团队将这两种胆汁酸代谢产物中的每种施用于小鼠时,他们观察到它们的Th17和Treg细胞相应地下降和上升。此外,他们还发现人类粪便(包括IBD患者的粪便)中也存在这两种胆汁酸副产物。
Huh补充道,“我们的发现鉴定出肠道免疫的一种重要的调节机制:肠道中的微生物可以修饰胆汁酸并将它们转变为炎症调节物。”
如果在进一步的研究中得到证实,那么这些结果可能有助于人们开发靶向Treg和Th17细胞的小分子药物来控制炎症并治疗影响肠道的自身免疫性疾病。
在第二项研究中,哈佛医学院布拉瓦尼克研究所免疫学教授Dennis Kasper及其研究团队着重研究了由于暴露于肠道微生物而结肠中产生的一个抑制炎症的Treg细胞亚群(称为结肠Treg细胞)。相反而言,大多数其他的免疫细胞起源于胸腺。相关研究结果近期发表在Nature期刊上,论文标题为“Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis”。
较低的结肠Treg细胞水平与诸如IBD和克罗恩病之类的自身免疫性疾病产生相关。
Kasper的实验表明肠道微生物和饮食可以协同作用来修饰胆汁酸,进而影响小鼠中的结肠Treg细胞水平。他们还发现由于缺乏胆汁酸或胆汁酸传感蛋白而诱导的结肠Treg细胞水平低下,使得小鼠容易患上炎症性结肠炎(inflammatory colitis),即一种类似于人IBD的疾病。
为了验证肠道细菌将对因摄入食物而产生的食源性胆汁酸转化为免疫信号分子的假设,Kasper团队沉默了多种肠道细菌中的胆汁酸转化基因,然后将经过基因修饰和未经过基因修饰的肠道细菌定植到经专门培育而使得肠道无菌的小鼠体内。肠道中接受缺乏胆汁酸转化基因的肠道细菌定植的小鼠具有明显下降的结肠Treg细胞水平。他们随后给这些小鼠喂食营养丰富的食物或最低限度食物(minimal food,即维持生命所需的最低限度食物)。
相比于摄入营养丰富的食物,携带正常肠道微生物的小鼠在摄入最低限度食物后具有更低的结肠Treg细胞水平和胆汁酸水平。但是,肠道无菌的小鼠在摄入营养丰富的食物后也具有较低的Treg细胞水平---这一发现表明肠道微生物和食源性胆汁酸都是调节免疫细胞水平所必需的。
为了测试胆汁酸是否直接参与免疫细胞调节,Kasper团队随后将各种胆汁酸分子与具有较低Treg细胞水平且摄入最低限度食物的小鼠的饮用水混合。几周之后,这些小鼠体内的抑制炎症的Treg细胞水平增加了。
在最后一步,Kasper团队给予三组小鼠一种诱导结肠炎的化合物。第一组小鼠接受摄入未添加胆汁酸分子的最低限度食物,第二组小鼠摄入营养丰富的食物,第三组小鼠摄入最低限度食物并喝添加着胆汁酸分子的饮用水。正如预期的那样,仅那些摄入未添加胆汁酸分子的最低限度食物的小鼠患上结肠炎。这就证实胆汁酸在Treg细胞调节、肠道炎症和结肠炎风险中起关键作用。
Kasper,“我们的研究结果证实肠道微生物、胆汁酸和免疫系统之间存在着优雅的三方相互作用。重要的是,我们的研究提示着考虑利用某些肠道细菌作为调节疾病风险的方法是合理的。”(生物谷 Bioon.com)
参考资料:
1.Saiyu Hang et al. Bile acid metabolites control TH17 and Treg cell differentiation. Nature, 2019, doi:10.1038/s41586-019-1785-z.
2.Xinyang Song et al. Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis. Nature, 2019, doi:10.1038/s41586-019-1865-0.
3.Fat-dissolving bile acids may help regulate gut immunity and inflammation
https://medicalxpress.com/news/2020-01-fat-dissolving-bile-acids-gut-immunity.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


