诱导性多能干细胞研究进展(第3期)
来源:本站原创 2019-10-28 23:59
2019年10月28日讯/生物谷BIOON/---诱导性多能干细胞(iPS细胞)最初是日本科学家山中伸弥(Shinya Yamanaka)团队在2006年利用病毒载体将四个转录因子(Oct4, Sox2, Klf4 和c-Myc)的组合转入到小鼠胚胎或皮肤纤维母细胞中,使其重编程而得到的类似胚胎干细胞的一种细胞类型。这些ips细胞在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形
2019年10月28日讯/生物谷BIOON/---诱导性多能干细胞(iPS细胞)最初是日本科学家山中伸弥(Shinya Yamanaka)团队在2006年利用病毒载体将四个转录因子(Oct4, Sox2, Klf4 和c-Myc)的组合转入到小鼠胚胎或皮肤纤维母细胞中,使其重编程而得到的类似胚胎干细胞的一种细胞类型。这些ips细胞在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤生成能力、分化能力等都与胚胎干细胞极为相似。
2007年11月,由中国科学家俞君英领衔的Thompson实验室和山中伸弥实验室几乎同时报道,成功地诱导人皮肤纤维母细胞成为几乎与胚胎干细胞完全一样的ips细胞,所不同的是日本实验室依然采用了用逆转录病毒引入Oct3/4、Sox2、c-Myc和Klf4四种因子组合,而Thompson实验室采用了以慢病毒载体引入Oct4、Sox2加Nanog和LIN28这种因子组合。
相比于胚胎干细胞,iPS细胞不会产生伦理问题,而且利用宿主自身的成体细胞(如皮肤细胞、血细胞等)经重编程变成iPS细胞,将它们移植回相同个体,应该有可能不会引发免疫反应,此外iPS细胞非常适合用来构建疾病模型,不过将iPS细胞用于治疗时也有风险:让ips细胞移植到体内时有可能会产生肿瘤。值得注意的是,近年来,日本科学家在人体中开展了基于ips细胞的临床试验来治疗疾病,取得了一定的成功。
基于此,小编针对近年来ips细胞研究取得的进展,小编进行一番梳理,以飨读者。
1.PNAS:将人诱导性多能干细胞转化为产生睾酮的睾丸间质细胞
doi:10.1073/pnas.1908207116
在一项新的研究中,来自美国南加州大学和加拿大麦吉尔大学的研究人员在实验室中成功地制造出人体中产生睾酮的细胞,这就为有朝一日利用个性化的替代细胞治疗低睾酮患者铺平了道路。相关研究结果于2019年10月7日在线发表在PNAS期刊上,论文标题为“Directing differentiation of human induced pluripotent stem cells toward androgen-producing Leydig cells rather than adrenal cells”。在这篇论文中,他们描述了他们如何将干细胞转化为功能性睾丸间质细胞(Leydig cell)---睾丸中产生男性性激素的细胞。

具体而言,Papadopoulos及其团队使用了称为人诱导性多能干细胞(hipsC)的干细胞,它们是通过对来自人体血液或皮肤的细胞进行重编程而产生的,可以分化为治疗时所需的任何类型的细胞。凭着直觉,Papadopoulos在细胞培养液中添加人胶原蛋白,并且添加将hipsC转化为睾丸间质细胞所需的基因和其他营养成分。胶原蛋白是一种常见的生长基质成分。以前,Papadopoulos使用的是牛胶原蛋白或大鼠胶原蛋白,它们更便宜,而且至少在早期实验中可以与其他形式的胶原蛋白互换。这次,实验室制造出的睾丸间质细胞产生了睾酮,而且这些细胞在显微镜下甚至看起来与天然存在的睾丸间质细胞相同。
2.Biochem Pharmacol:发现促进心脏细胞成熟的新方法
doi:10.1016/j.bcp.2019.08.010
来自Masonic医学研究所(MMRI)的科学家与Nanion Technologies合作,最近在《生化药理学》(Biochemical Pharmacology)上发表了一项研究,解决了钾(K+)电流在人诱导多能干细胞衍生心肌细胞(hipsC-CMs)中缺陷的问题。
在本研究中,MMRI科学家确定了hipsC-CMs通过两种不同类型的K+通道的激活剂--瞬时向外K+电流(Ito)和快速延迟整流K+电流(IKr)--刺激是否可以改善复极化储备,产生功能更成熟的心脏细胞。
这些实验集中在电生理学领域,即研究生物细胞和组织的电特性。结果表明,在hiPSC-CMs中,激活物仅能增强IKr电流,而不能增强Ito电流。尽管如此,IKr增强单独改善hiPSC-CMs的复极化储备,更充分地分化心脏细胞。此外,他们的研究还偶然发现在hipsC-CMs中只有一个K+通道是由双激活剂诱导的;在成熟的心脏细胞中,同一激活因子可同时激活两个通道。这些数据表明,hipsC-CMs与成熟的成年心脏细胞之间的药理作用的结论需要进行审查。
3.Nature:全球首例!一名日本妇女成功接受由重编程干细胞制成的角膜进行的移植手术!
doi:10.1038/d41586-019-02597-2
近日,一名四十多岁的日本女性成为了世界上首个使用重编程干细胞修复角膜的人,在8月29号的新闻发布会上,来自日本大阪大学的眼科专家Kohji Nishida表示,这名女性眼睛中修复角膜的干细胞发生了丢失,角膜是覆盖并保护眼睛的一层透明层结构,这种状况会使她视力模糊并可能导致失明。
为了对这名女性进行治疗,研究者表示,他们的团队利用诱导多能干细胞(ips)制造出了角膜细胞片,通过将来自供体的皮肤细胞重编程为胚胎样状态,随后细胞就能够转化称为其它类型的细胞,比如角膜细胞等。研究者Nishida说道,自从一个月前接受移植手术以来,这名女性眼睛中的角膜依然清晰,而且视力也有所改善。
目前,患有受损或病变眼角膜的患者通常会使用去世捐赠者的眼角膜组织来进行治疗,但在日本,需要诸如眼角膜等组织进行移植的患者排队的名单很长,而且等待时间很久。如今,日本批准iPS细胞在临床应用方面走在世界前列,此前,来自日本京都大学的干细胞学家Shinya Yamanaka因干细胞研究而获得诺贝尔奖,日本的医生还使用ips细胞来治疗脊髓损伤、帕金森疾病和另外一种眼部疾病的患者。
4.ACS Nano:新型纳米技术平台有望加速干细胞移植领域研究
doi:10.1021/acsnano.9b01875
近日,一项刊登在国际杂志ACS Nano上的研究报告中,来自罗格斯大学的科学家们通过研究开发了一种新型纳米技术,其或能增强对干细胞移植的研究,有望帮助改善多种疾病人群的治疗,包括阿尔兹海默病、帕金森疾病、其它神经变性疾病和中枢神经型损伤等。
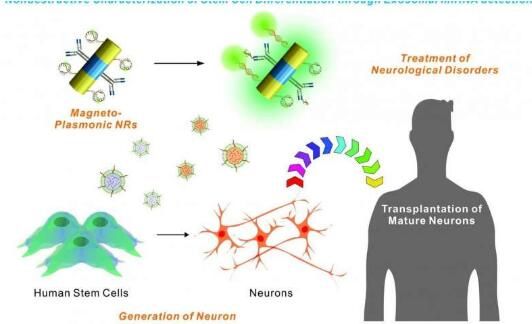
研究者开发的这种新型纳米技术平台利用特殊的小棒结构来进行感应,其能帮助研究者证实人类干细胞的身份以及相应的生物标志物,同时并不会破坏这些干细胞;这是干细胞临床研究中研究人员所要面对的问题,因为其限制了后期进一步的分析和生物医学应用。研究者KiBum Lee教授说道,当前基于干细胞疗法所面临的一个主要障碍就是标准细胞表征步骤的破坏性,基于新开发的纳米技术,我们就能够在不损害细胞活力的前体下,灵敏而准确地对细胞进行特征表征。
利用这种新型纳米技术平台,研究人员就能通过对细胞所释放的名为外泌体微小颗粒的新一代生物标志物进行特征表征,来监测人类干细胞衍生的神经元细胞的水平,外泌体在细胞间的信号传输上扮演着非常关键的角色,后期研究人员还将继续深入研究调查这种新型纳米技术在其它应用中的多样性,比如在临床环境中检测神经元细胞。
5.Circulation:科学家有望利用干细胞衍生的心肌细胞来修复受损的心脏!
doi:10.1161/CIRCULATIONAHA.119.040881
近日,一项刊登在国际杂志Circulation上的研究报告中,来自阿拉巴马大学伯明翰分校的科学家们通过研究开发了一种新方法,其或能利用干细胞衍生的心肌细胞来改善心脏病的修复;心脏病发作后会引发部分肌肉壁死亡,从而就会使心脏无法再生,死亡的组织会压迫周围的肌肉导致患者出现致命性的心脏扩张。
这项研究中,研究人员开发了一种新方法来改善所移植细胞的质量,他们表示,在心脏病小鼠模型中进行试验后发现,注射的干细胞衍生的心肌细胞的移植率提高了一倍,这种新方法能够在异质群体中选择功能完整且DNA完整的细胞,从而使其能够适应临床状况,更好地重建缺血的心肌组织并改善衰竭心脏的功能表现。心脏细胞的移植需要数百万的干细胞或其衍生细胞,在加速状况下的细胞繁殖是获取大量细胞的常用手段,但加速生长也会造成培养的压力,包括致死性的DNA损伤,这些DNA损伤的细胞或许无法适用于细胞移植。
研究者表示,他们能够激活诱导多能干细胞中的转录因子p53从而选择性地诱导程序性细胞死亡(细胞凋亡)发生,尤其是DNA损伤的细胞,同时还会保留DNA未发生损伤的细胞;研究者利用MDM2抑制剂(Nutlin-3a)能够激活p53的表达,当进行Nutlin-3a疗法后,死亡的细胞就会从培养液中被洗掉,剩下的DNA未受到损伤的细胞则会正常生长并分化为心肌细胞;随后研究者将90万个衍生的心肌细胞注射到了心脏病小鼠模型心脏左心室的边界区域,四周后,研究者发现,接受DNA未发生损伤的心肌细胞的心脏中植入率发生了明显提高(大约14%),而对照衍生的心肌细胞的植入率则约为7%。
6.Cell Metab:首次在实验室中培育出转基因迷你肝脏组织 有望帮助研究肝脏疾病及开发新型疗法
doi:10.1016/j.cmet.2019.06.017
近日,一项刊登在国际杂志Cell Metabolism上的研究报告中,来自匹兹堡大学的科学家们通过研究在实验室中首次培育出了转基因(遗传修饰,genetically modified)的微型人类肝脏,其或有望帮助模拟人类肝脏疾病的进展及新型疗法的开发。
文章中,研究者阐明了他们如何将遗传工程化的人类细胞转化称为功能性的3D肝脏组织,这些肝脏组织能够模拟费酒精性脂肪肝(NAFLD,non-alcoholic fatty liver disease),非酒精性脂肪肝是一种脂肪堆积的肝脏疾病,其常常会引发肝硬化甚至肝脏功能衰竭等,如今随着美国人群肥胖率不断上升,非酒精性脂肪肝已经成为了引发慢性肝脏疾病的主要原因。
医学博士Alejandro Soto-Gutierrez说道,这项研究中,我们在实验室中首次利用干细胞制造出了遗传工程化的人类模拟肝脏组织(疾病状态),这非常重要,因为其不仅能帮助我们理解诱发肝脏疾病及肝脏疾病进展的机制,同时还能帮助开发新型治疗手段,目前开发的很多药物尽管在小鼠身上有很少的疗效,但在临床试验中常常是无效或者失败的;比如,药物白藜芦醇,其就能在小鼠模型中发挥有效作用,然而在人类临床试验中却并无效果,白藜芦醇能够对与非酒精性脂肪肝相关的SIRT1蛋白发挥作用。
研究者表示,小鼠并非人类,我们一出生就携带有特定的突变,即多态性(polymorphisms),其会促使我们易患某些疾病,但我们却并未在小鼠机体中研究过这种多态性,因此制造出一种迷你个性化的人类肝脏或许是非常有用的。这项研究中,研究人员首先对正常的人类皮肤细胞进行遗传工程化修饰使其能够表达一种化学活性开关,从而降低SIRT1基因的表达,随后研究者将这些细胞重编程使其回归到干细胞状态,并将其转化为肝细胞;一切就绪之后,研究者将遗传工程化所得到的人类肝脏细胞植入到小鼠的肝脏中,在小鼠肝脏中,这些细胞就能够发育成为具有正常血管和其它结构特征的功能性3-D模拟肝脏。
7.Circulation:深入揭示CPVT遗传性心律失常的致病机制
doi:10.1161/CIRCULATIONAHA.119.039711
在一项新的研究中,来自美国波士顿儿童医院的研究人员报道了首个遗传性心律失常的人体组织模型,在培养皿中再现了两名患者的心律失常。这就为开发治疗心律异常的方法奠定了基础。相关研究结果于2019年7月17日在线发表在Circulation期刊上,论文标题为“Insights into the Pathogenesis of Catecholaminergic Polymorphic Ventricular Tachycardia from Engineered Human Heart Tissue”。

通过与波士顿儿童医院的Dominic Abrams博士领导的遗传性心律失常项目合作,这些研究人员从波士顿儿童医院的两名患者那里获得了血液样本。这两名患者因基因RYR2发生的不同突变而患上CPVT,此外,大多数CPVT病例与这个基因相关。RYR2基因编码的一种通道蛋白能够让细胞释放钙离子,这是引发心脏收缩的第一步。
这些研究人员随后将患者的血细胞重编程为诱导性多能干细胞(iPS细胞),ips细胞几乎可以产生所有的细胞类型。由此,他们产生携带CPVT突变的心肌细胞,并用它们构建心肌组织模型。
通过使用所谓的光遗传学系统,这些研究人员随后将蓝光施加于这种组织模型的一端以激活这些心肌细胞。这产生了一种沿着这种细胞片(即前面提及的心肌组织模型)移动的冲动,从而产生收缩。通过使用这种系统,他们构建出“培养皿中的运动测试(exercise test in a dish)”。为了模拟运动,他们添加了药物异丙肾上腺素(类似于称为肾上腺素的应激激素)并施加红外线来启动更快的心跳。这项测试有助于揭示CPVT的内在致病机理。当健康的心脏组织进行运动测试时,钙离子以均匀波(even wave)穿过这种组织。但是在利用CPVT患者的ips细胞制造出的组织模型中,钙离子波以不同的速度移动,并且在这种组织模型的某些部分根本不移动,从而导致称为折返性(re-entry)的异常圆周运动---就像在现实生活中发生的那样。
8.Cell Metab: 科学家们通过构建工程化肝脏找到治疗肝病的新方法
doi:10.1016/j.cmet.2019.05.007
科学家成功地构建出生物工程化人类肝脏类器官,能够准确地模拟致命肝脏疾病的关键特征。这使他们能够发现潜在的疾病生物学机制,并开发相应的疗法。
在《Cell Metabolism》杂志在线发表的研究结果中,辛辛那提儿童医院医学中心的研究人员表示,他们的研究克服了解决肝脏疾病的分子奥秘和寻找迫切需要的新疗法的主要障碍。研究作者表示,它还可以通过个性化方法研究肝病中的炎症和纤维化,这些方法与个体患者的独特遗传学和生物学相匹配。
“尽管目前的人体器官系统可以在像小鼠这样的活体实验室生物体中重建器官结构,但它们无法捕捉到肝脏疾病中炎症和纤维化的复杂病症,”作者Takanori Takebe说道。
“我们利用源自健康人类供体和肝脏疾病的多能干细胞,开发了一种可重复生物工程复合多细胞人肝脏类器官的方法。这些类器官产生不同类型的肝细胞,如肝细胞,星状细胞和Kupffer样细胞,它们准确地在实验室中重现炎症,纤维化和肝病的其他特征。”
9.Stem Cells:新技术或能利用几毫升血液制造大量干细胞 有望开发出心血管疾病潜在疗法
doi:10.1002/stem.2936
近日,一项刊登在国际杂志Stem Cells上的研究报告中,来自贝尔法斯特女王大学的科学家们通过研究有望开发出治疗血管和糖尿病相关的心血管疾病的新型疗法。文章中,研究人员开发了一种新技术,其能利用少量血液样本在短时间内产生大量干细胞,随后这些干细胞能够替代血管内损伤的细胞,这种疗法有望抑制糖尿病患者多种血管相关的并发症,包括心脏病发作、肾脏疾病和失明等。
研究者Andriana Margariti表示,能在短时间内利用几毫升血液产生大量干细胞,这或许是一项真正的开创性成就,有望彻底改变我们治疗大量血管疾病的方式或模式;此前进行细胞转化过程往往会涉及皮肤的活组织检查或需要大量血液,这对于许多患者而言根本不可行,因为对于患者风险很大且需要很长的恢复时间。
本文研究中,研究人员重点对治疗血管疾病的干细胞进行研究,他们还能利用同样的过程来产生用于分化成多种器官的干细胞,包括大脑和肾脏等。研究者发现,激活干细胞中一种名为内皮特异性分子1(ESM1,Endothelial Specific Molecule 1)的特殊基因或能增强新生内皮细胞的产生和功能,这种新生的内皮细胞在多种血管疾病发生过程中扮演着关键角色。
10.Nature:世界上首个三类器官系统为医学研究和诊断打开了大门
doi:10.1038/s41586-019-1598-0
在一项新的研究中,来自美国辛辛那提儿童医学中心和日本东京医科牙科大学的研究人员报道肝脏、胆管和胰腺结构的连续模式和动态形态发生,这些结构是由人多能性干细胞的三维培养物内陷形成的。由人多能性干细胞分化而来的前肠球状体和后肠球状体之间的边界相互作用使得肝脏-胆管-胰腺结构在没有外来因素的情形下在前肠-中肠边界的类器官上发生特化而形成,这种形成依赖于视黄酸。相关研究结果发表在2019年10月3日的Nature期刊上,论文标题为“Modelling human hepato-biliary-pancreatic organogenesis from the foregut–midgut boundary”。
尽管移植物衍生的组织以中肠衍生物为主,但是显微切割的肝脏-胆管-胰腺类器官在长期体外培养时发育成分离的多器官原基(multi-organ anlages),这随后就概述了早期形态发生事件,包括三个不同且相互连接的器官结构的内陷和分支,这让人想起由小鼠外植前肠-中肠培养物衍生的组织。正如在体内观察到的那样,由HES1基因突变引起的多器官结构的错误分离会破坏体外培养物的胆管特化潜力。
总而言之,这些研究人员证实通过前肠组织和中肠组织的并置可以建立一种实验性多器官整合模型,这潜在地为研究复杂的人类内胚层器官发生提供一种易处理、可操作且易于获得的模型。(生物谷 Bioon.com)
2007年11月,由中国科学家俞君英领衔的Thompson实验室和山中伸弥实验室几乎同时报道,成功地诱导人皮肤纤维母细胞成为几乎与胚胎干细胞完全一样的ips细胞,所不同的是日本实验室依然采用了用逆转录病毒引入Oct3/4、Sox2、c-Myc和Klf4四种因子组合,而Thompson实验室采用了以慢病毒载体引入Oct4、Sox2加Nanog和LIN28这种因子组合。
相比于胚胎干细胞,iPS细胞不会产生伦理问题,而且利用宿主自身的成体细胞(如皮肤细胞、血细胞等)经重编程变成iPS细胞,将它们移植回相同个体,应该有可能不会引发免疫反应,此外iPS细胞非常适合用来构建疾病模型,不过将iPS细胞用于治疗时也有风险:让ips细胞移植到体内时有可能会产生肿瘤。值得注意的是,近年来,日本科学家在人体中开展了基于ips细胞的临床试验来治疗疾病,取得了一定的成功。
基于此,小编针对近年来ips细胞研究取得的进展,小编进行一番梳理,以飨读者。
1.PNAS:将人诱导性多能干细胞转化为产生睾酮的睾丸间质细胞
doi:10.1073/pnas.1908207116
在一项新的研究中,来自美国南加州大学和加拿大麦吉尔大学的研究人员在实验室中成功地制造出人体中产生睾酮的细胞,这就为有朝一日利用个性化的替代细胞治疗低睾酮患者铺平了道路。相关研究结果于2019年10月7日在线发表在PNAS期刊上,论文标题为“Directing differentiation of human induced pluripotent stem cells toward androgen-producing Leydig cells rather than adrenal cells”。在这篇论文中,他们描述了他们如何将干细胞转化为功能性睾丸间质细胞(Leydig cell)---睾丸中产生男性性激素的细胞。

睾丸间质细胞的高放大倍数显微图,图片来自Nephron/Wikipedia。
具体而言,Papadopoulos及其团队使用了称为人诱导性多能干细胞(hipsC)的干细胞,它们是通过对来自人体血液或皮肤的细胞进行重编程而产生的,可以分化为治疗时所需的任何类型的细胞。凭着直觉,Papadopoulos在细胞培养液中添加人胶原蛋白,并且添加将hipsC转化为睾丸间质细胞所需的基因和其他营养成分。胶原蛋白是一种常见的生长基质成分。以前,Papadopoulos使用的是牛胶原蛋白或大鼠胶原蛋白,它们更便宜,而且至少在早期实验中可以与其他形式的胶原蛋白互换。这次,实验室制造出的睾丸间质细胞产生了睾酮,而且这些细胞在显微镜下甚至看起来与天然存在的睾丸间质细胞相同。
2.Biochem Pharmacol:发现促进心脏细胞成熟的新方法
doi:10.1016/j.bcp.2019.08.010
来自Masonic医学研究所(MMRI)的科学家与Nanion Technologies合作,最近在《生化药理学》(Biochemical Pharmacology)上发表了一项研究,解决了钾(K+)电流在人诱导多能干细胞衍生心肌细胞(hipsC-CMs)中缺陷的问题。
在本研究中,MMRI科学家确定了hipsC-CMs通过两种不同类型的K+通道的激活剂--瞬时向外K+电流(Ito)和快速延迟整流K+电流(IKr)--刺激是否可以改善复极化储备,产生功能更成熟的心脏细胞。
这些实验集中在电生理学领域,即研究生物细胞和组织的电特性。结果表明,在hiPSC-CMs中,激活物仅能增强IKr电流,而不能增强Ito电流。尽管如此,IKr增强单独改善hiPSC-CMs的复极化储备,更充分地分化心脏细胞。此外,他们的研究还偶然发现在hipsC-CMs中只有一个K+通道是由双激活剂诱导的;在成熟的心脏细胞中,同一激活因子可同时激活两个通道。这些数据表明,hipsC-CMs与成熟的成年心脏细胞之间的药理作用的结论需要进行审查。
3.Nature:全球首例!一名日本妇女成功接受由重编程干细胞制成的角膜进行的移植手术!
doi:10.1038/d41586-019-02597-2
近日,一名四十多岁的日本女性成为了世界上首个使用重编程干细胞修复角膜的人,在8月29号的新闻发布会上,来自日本大阪大学的眼科专家Kohji Nishida表示,这名女性眼睛中修复角膜的干细胞发生了丢失,角膜是覆盖并保护眼睛的一层透明层结构,这种状况会使她视力模糊并可能导致失明。
为了对这名女性进行治疗,研究者表示,他们的团队利用诱导多能干细胞(ips)制造出了角膜细胞片,通过将来自供体的皮肤细胞重编程为胚胎样状态,随后细胞就能够转化称为其它类型的细胞,比如角膜细胞等。研究者Nishida说道,自从一个月前接受移植手术以来,这名女性眼睛中的角膜依然清晰,而且视力也有所改善。
目前,患有受损或病变眼角膜的患者通常会使用去世捐赠者的眼角膜组织来进行治疗,但在日本,需要诸如眼角膜等组织进行移植的患者排队的名单很长,而且等待时间很久。如今,日本批准iPS细胞在临床应用方面走在世界前列,此前,来自日本京都大学的干细胞学家Shinya Yamanaka因干细胞研究而获得诺贝尔奖,日本的医生还使用ips细胞来治疗脊髓损伤、帕金森疾病和另外一种眼部疾病的患者。
4.ACS Nano:新型纳米技术平台有望加速干细胞移植领域研究
doi:10.1021/acsnano.9b01875
近日,一项刊登在国际杂志ACS Nano上的研究报告中,来自罗格斯大学的科学家们通过研究开发了一种新型纳米技术,其或能增强对干细胞移植的研究,有望帮助改善多种疾病人群的治疗,包括阿尔兹海默病、帕金森疾病、其它神经变性疾病和中枢神经型损伤等。

图片来源: Jin-Ho Lee/Rutgers University-New Brunswick。
研究者开发的这种新型纳米技术平台利用特殊的小棒结构来进行感应,其能帮助研究者证实人类干细胞的身份以及相应的生物标志物,同时并不会破坏这些干细胞;这是干细胞临床研究中研究人员所要面对的问题,因为其限制了后期进一步的分析和生物医学应用。研究者KiBum Lee教授说道,当前基于干细胞疗法所面临的一个主要障碍就是标准细胞表征步骤的破坏性,基于新开发的纳米技术,我们就能够在不损害细胞活力的前体下,灵敏而准确地对细胞进行特征表征。
利用这种新型纳米技术平台,研究人员就能通过对细胞所释放的名为外泌体微小颗粒的新一代生物标志物进行特征表征,来监测人类干细胞衍生的神经元细胞的水平,外泌体在细胞间的信号传输上扮演着非常关键的角色,后期研究人员还将继续深入研究调查这种新型纳米技术在其它应用中的多样性,比如在临床环境中检测神经元细胞。
5.Circulation:科学家有望利用干细胞衍生的心肌细胞来修复受损的心脏!
doi:10.1161/CIRCULATIONAHA.119.040881
近日,一项刊登在国际杂志Circulation上的研究报告中,来自阿拉巴马大学伯明翰分校的科学家们通过研究开发了一种新方法,其或能利用干细胞衍生的心肌细胞来改善心脏病的修复;心脏病发作后会引发部分肌肉壁死亡,从而就会使心脏无法再生,死亡的组织会压迫周围的肌肉导致患者出现致命性的心脏扩张。
这项研究中,研究人员开发了一种新方法来改善所移植细胞的质量,他们表示,在心脏病小鼠模型中进行试验后发现,注射的干细胞衍生的心肌细胞的移植率提高了一倍,这种新方法能够在异质群体中选择功能完整且DNA完整的细胞,从而使其能够适应临床状况,更好地重建缺血的心肌组织并改善衰竭心脏的功能表现。心脏细胞的移植需要数百万的干细胞或其衍生细胞,在加速状况下的细胞繁殖是获取大量细胞的常用手段,但加速生长也会造成培养的压力,包括致死性的DNA损伤,这些DNA损伤的细胞或许无法适用于细胞移植。
研究者表示,他们能够激活诱导多能干细胞中的转录因子p53从而选择性地诱导程序性细胞死亡(细胞凋亡)发生,尤其是DNA损伤的细胞,同时还会保留DNA未发生损伤的细胞;研究者利用MDM2抑制剂(Nutlin-3a)能够激活p53的表达,当进行Nutlin-3a疗法后,死亡的细胞就会从培养液中被洗掉,剩下的DNA未受到损伤的细胞则会正常生长并分化为心肌细胞;随后研究者将90万个衍生的心肌细胞注射到了心脏病小鼠模型心脏左心室的边界区域,四周后,研究者发现,接受DNA未发生损伤的心肌细胞的心脏中植入率发生了明显提高(大约14%),而对照衍生的心肌细胞的植入率则约为7%。
6.Cell Metab:首次在实验室中培育出转基因迷你肝脏组织 有望帮助研究肝脏疾病及开发新型疗法
doi:10.1016/j.cmet.2019.06.017
近日,一项刊登在国际杂志Cell Metabolism上的研究报告中,来自匹兹堡大学的科学家们通过研究在实验室中首次培育出了转基因(遗传修饰,genetically modified)的微型人类肝脏,其或有望帮助模拟人类肝脏疾病的进展及新型疗法的开发。
文章中,研究者阐明了他们如何将遗传工程化的人类细胞转化称为功能性的3D肝脏组织,这些肝脏组织能够模拟费酒精性脂肪肝(NAFLD,non-alcoholic fatty liver disease),非酒精性脂肪肝是一种脂肪堆积的肝脏疾病,其常常会引发肝硬化甚至肝脏功能衰竭等,如今随着美国人群肥胖率不断上升,非酒精性脂肪肝已经成为了引发慢性肝脏疾病的主要原因。
医学博士Alejandro Soto-Gutierrez说道,这项研究中,我们在实验室中首次利用干细胞制造出了遗传工程化的人类模拟肝脏组织(疾病状态),这非常重要,因为其不仅能帮助我们理解诱发肝脏疾病及肝脏疾病进展的机制,同时还能帮助开发新型治疗手段,目前开发的很多药物尽管在小鼠身上有很少的疗效,但在临床试验中常常是无效或者失败的;比如,药物白藜芦醇,其就能在小鼠模型中发挥有效作用,然而在人类临床试验中却并无效果,白藜芦醇能够对与非酒精性脂肪肝相关的SIRT1蛋白发挥作用。
研究者表示,小鼠并非人类,我们一出生就携带有特定的突变,即多态性(polymorphisms),其会促使我们易患某些疾病,但我们却并未在小鼠机体中研究过这种多态性,因此制造出一种迷你个性化的人类肝脏或许是非常有用的。这项研究中,研究人员首先对正常的人类皮肤细胞进行遗传工程化修饰使其能够表达一种化学活性开关,从而降低SIRT1基因的表达,随后研究者将这些细胞重编程使其回归到干细胞状态,并将其转化为肝细胞;一切就绪之后,研究者将遗传工程化所得到的人类肝脏细胞植入到小鼠的肝脏中,在小鼠肝脏中,这些细胞就能够发育成为具有正常血管和其它结构特征的功能性3-D模拟肝脏。
7.Circulation:深入揭示CPVT遗传性心律失常的致病机制
doi:10.1161/CIRCULATIONAHA.119.039711
在一项新的研究中,来自美国波士顿儿童医院的研究人员报道了首个遗传性心律失常的人体组织模型,在培养皿中再现了两名患者的心律失常。这就为开发治疗心律异常的方法奠定了基础。相关研究结果于2019年7月17日在线发表在Circulation期刊上,论文标题为“Insights into the Pathogenesis of Catecholaminergic Polymorphic Ventricular Tachycardia from Engineered Human Heart Tissue”。

图片来自Sung Jin Park and Donghui Zhang from the Kevin Kit Parker and William T. Pu Laboratories, Boston Children's Hospital and Harvard SEAS。
通过与波士顿儿童医院的Dominic Abrams博士领导的遗传性心律失常项目合作,这些研究人员从波士顿儿童医院的两名患者那里获得了血液样本。这两名患者因基因RYR2发生的不同突变而患上CPVT,此外,大多数CPVT病例与这个基因相关。RYR2基因编码的一种通道蛋白能够让细胞释放钙离子,这是引发心脏收缩的第一步。
这些研究人员随后将患者的血细胞重编程为诱导性多能干细胞(iPS细胞),ips细胞几乎可以产生所有的细胞类型。由此,他们产生携带CPVT突变的心肌细胞,并用它们构建心肌组织模型。
通过使用所谓的光遗传学系统,这些研究人员随后将蓝光施加于这种组织模型的一端以激活这些心肌细胞。这产生了一种沿着这种细胞片(即前面提及的心肌组织模型)移动的冲动,从而产生收缩。通过使用这种系统,他们构建出“培养皿中的运动测试(exercise test in a dish)”。为了模拟运动,他们添加了药物异丙肾上腺素(类似于称为肾上腺素的应激激素)并施加红外线来启动更快的心跳。这项测试有助于揭示CPVT的内在致病机理。当健康的心脏组织进行运动测试时,钙离子以均匀波(even wave)穿过这种组织。但是在利用CPVT患者的ips细胞制造出的组织模型中,钙离子波以不同的速度移动,并且在这种组织模型的某些部分根本不移动,从而导致称为折返性(re-entry)的异常圆周运动---就像在现实生活中发生的那样。
8.Cell Metab: 科学家们通过构建工程化肝脏找到治疗肝病的新方法
doi:10.1016/j.cmet.2019.05.007
科学家成功地构建出生物工程化人类肝脏类器官,能够准确地模拟致命肝脏疾病的关键特征。这使他们能够发现潜在的疾病生物学机制,并开发相应的疗法。
在《Cell Metabolism》杂志在线发表的研究结果中,辛辛那提儿童医院医学中心的研究人员表示,他们的研究克服了解决肝脏疾病的分子奥秘和寻找迫切需要的新疗法的主要障碍。研究作者表示,它还可以通过个性化方法研究肝病中的炎症和纤维化,这些方法与个体患者的独特遗传学和生物学相匹配。
“尽管目前的人体器官系统可以在像小鼠这样的活体实验室生物体中重建器官结构,但它们无法捕捉到肝脏疾病中炎症和纤维化的复杂病症,”作者Takanori Takebe说道。
“我们利用源自健康人类供体和肝脏疾病的多能干细胞,开发了一种可重复生物工程复合多细胞人肝脏类器官的方法。这些类器官产生不同类型的肝细胞,如肝细胞,星状细胞和Kupffer样细胞,它们准确地在实验室中重现炎症,纤维化和肝病的其他特征。”
9.Stem Cells:新技术或能利用几毫升血液制造大量干细胞 有望开发出心血管疾病潜在疗法
doi:10.1002/stem.2936
近日,一项刊登在国际杂志Stem Cells上的研究报告中,来自贝尔法斯特女王大学的科学家们通过研究有望开发出治疗血管和糖尿病相关的心血管疾病的新型疗法。文章中,研究人员开发了一种新技术,其能利用少量血液样本在短时间内产生大量干细胞,随后这些干细胞能够替代血管内损伤的细胞,这种疗法有望抑制糖尿病患者多种血管相关的并发症,包括心脏病发作、肾脏疾病和失明等。
研究者Andriana Margariti表示,能在短时间内利用几毫升血液产生大量干细胞,这或许是一项真正的开创性成就,有望彻底改变我们治疗大量血管疾病的方式或模式;此前进行细胞转化过程往往会涉及皮肤的活组织检查或需要大量血液,这对于许多患者而言根本不可行,因为对于患者风险很大且需要很长的恢复时间。
本文研究中,研究人员重点对治疗血管疾病的干细胞进行研究,他们还能利用同样的过程来产生用于分化成多种器官的干细胞,包括大脑和肾脏等。研究者发现,激活干细胞中一种名为内皮特异性分子1(ESM1,Endothelial Specific Molecule 1)的特殊基因或能增强新生内皮细胞的产生和功能,这种新生的内皮细胞在多种血管疾病发生过程中扮演着关键角色。
10.Nature:世界上首个三类器官系统为医学研究和诊断打开了大门
doi:10.1038/s41586-019-1598-0
在一项新的研究中,来自美国辛辛那提儿童医学中心和日本东京医科牙科大学的研究人员报道肝脏、胆管和胰腺结构的连续模式和动态形态发生,这些结构是由人多能性干细胞的三维培养物内陷形成的。由人多能性干细胞分化而来的前肠球状体和后肠球状体之间的边界相互作用使得肝脏-胆管-胰腺结构在没有外来因素的情形下在前肠-中肠边界的类器官上发生特化而形成,这种形成依赖于视黄酸。相关研究结果发表在2019年10月3日的Nature期刊上,论文标题为“Modelling human hepato-biliary-pancreatic organogenesis from the foregut–midgut boundary”。

图片来自Cincinnati Children's。
尽管移植物衍生的组织以中肠衍生物为主,但是显微切割的肝脏-胆管-胰腺类器官在长期体外培养时发育成分离的多器官原基(multi-organ anlages),这随后就概述了早期形态发生事件,包括三个不同且相互连接的器官结构的内陷和分支,这让人想起由小鼠外植前肠-中肠培养物衍生的组织。正如在体内观察到的那样,由HES1基因突变引起的多器官结构的错误分离会破坏体外培养物的胆管特化潜力。
总而言之,这些研究人员证实通过前肠组织和中肠组织的并置可以建立一种实验性多器官整合模型,这潜在地为研究复杂的人类内胚层器官发生提供一种易处理、可操作且易于获得的模型。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


