肠道干细胞研究进展(第2期)
来源:本站原创 2019-10-28 23:08
2019年10月28日讯/生物谷BIOON/---从分子的角度来看,肠道是一个嘈杂的地方,各种人类细胞和微生物细胞彼此之间相互沟通,从而维持一种稳健而又健康的细胞群落。这个细胞群落的关键是肠道干细胞(intestinal stem cell),它们产生多种细胞类型,从而有助于保 持肠道功能正常。肠道干细胞位于肠黏膜隐窝基底部,即基底隐窝是肠道干细胞的细胞库。正常情况下,位于隐窝基底部的肠道干细胞不
2019年10月28日讯/生物谷BIOON/---从分子的角度来看,肠道是一个嘈杂的地方,各种人类细胞和微生物细胞彼此之间相互沟通,从而维持一种稳健而又健康的细胞群落。这个细胞群落的关键是肠道干细胞(intestinal stem cell),它们产生多种细胞类型,从而有助于保 持肠道功能正常。肠道干细胞位于肠黏膜隐窝基底部,即基底隐窝是肠道干细胞的细胞库。正常情况下,位于隐窝基底部的肠道干细胞不断向隐窝顶部(肠腔方向)迁移,整个迁移过程大约3至5天,在迁移过程中肠道干细胞分化形成不同的肠粘膜细胞。
针对肠道干细胞研究近期取得的进展,小编进行了一番盘点,以飨读者。
1.Cell:生酮饮食有益新证据!酮体产生增强肠道干细胞的再生能力
doi:10.1016/j.cell.2019.07.048
在一项新的研究中,来自美国麻省理工学院的研究人员发现了生酮饮食或高脂肪饮食的意外效果:高水平的酮体(ketone body),即脂肪分解产生的分子,有助于肠道维持大量的成体干细胞,这是对于保持肠道内壁健康至关重要。他们还发现即便在没有摄入高脂肪饮食的情形下,肠道干细胞会也产生异常高水平的酮体。这些酮体激活了一种众所周知的称为Notch的信号通路,该通路之前已被证实有助于调节干细胞分化。相关研究结果近期发表在Cell期刊上,论文标题为“Ketone Body Signaling Mediates Intestinal Stem Cell Homeostasis and Adaptation to Diet”。
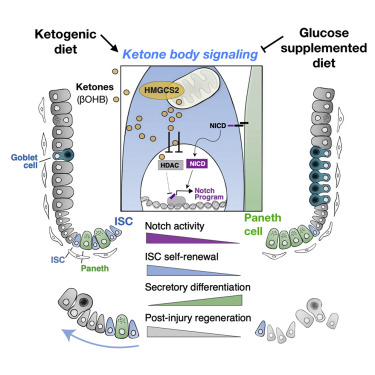
论文通讯作者、麻省理工学院科赫综合癌症研究所成员、生物学副教授Omer Yilmaz说,“酮体是代谢物如何指导肠道干细胞命运的首批例子之一。这些酮体通常被认为在营养压力期间在能量维持中起关键作用,它们通过激活Notch通路来增强干细胞功能。不同营养状态或饮食中酮体水平的变化使得干细胞能够适应不同的生理学条件。”
在这项针对小鼠的研究中,这些研究人员发现,与摄入正常饮食的小鼠体内的肠道干细胞相比,生酮饮食增强肠道干细胞的再生能力,使得它们能够更好地从肠道内壁的损伤中恢复过来。
2.Nature:靶向潘氏细胞产生的Notum可让衰老的肠道干细胞恢复青春
doi:10.1038/s41586-019-1383-0
在一项新的研究中,来自芬兰赫尔辛基大学的研究人员发现随着年龄的增加,肠上皮的再生能力如何发生下降。靶向一种抑制干胞维持信号转导的酶可让老化的肠道恢复再生潜力。这一发现可能指出了缓解年龄相关的胃肠道问题、降低癌症治疗副作用和通过促进康复降低老龄化社会的医疗成本的方法。相关研究结果于2019年7月10日在线发表在Nature期刊上,论文标题为“Notum produced by Paneth cells attenuates regeneration of aged intestinal epithelium”。
年龄引起的组织更新能力下降使得许多常见药物的剂量具有挑战性。靶向一种称为Notum的抑制因子可能提供一种新的方法来增加治疗窗口并促进人口老龄化社会康复。这些研究人员认为除了直接靶向Notum之外,饮食等生活方式因素也可能提供减少Notum因而改善组织更新和修复的方法。
通过使用类器官培养方法,这些研究人员了解到修复组织的干细胞在老化肠道中表现出的功能不良归因于来自邻近的称为潘氏细胞(Paneth cell)的细胞的异常信号。
在正常情形下,肠上皮由依赖于Wnt信号通路活性的干细胞更新。邻近的细胞产生激活这种信号通路的分子。这项新的研究表明,在衰老期间,潘氏细胞开始表达一种分泌性的Wnt抑制剂,即Notum。Notum酶促地让干细胞壁龛(stem cell niche)中的Wnt配体失活,从而降低肠道干细胞的再生潜力。然而,对Notum进行药物抑制可恢复干细胞活性,并且在用一种常用的在肠道中具有严重副作用的化疗药物治疗后促进老年动物的康复。
3.Nature:挑战常规!胎儿中的所有肠道细胞都潜力发育成肠道干细胞
doi:10.1038/s41586-019-1212-5
在一项轰动性的新研究中,来自丹麦哥本哈根大学等研究机构的研究人员反驳了关于干细胞产生的传统观点。他们得出结论:胎儿肠道中的所有细胞都有潜力发育为干细胞。他们揭示出肠道细胞的命运并不是事先确定的,而是由这些细胞的周围环境决定的。这种新的知识可能让人们容易操纵干细胞用于干细胞治疗。相关研究结果于2019年5月15日在线发表在Nature期刊上,论文标题为“Tracing the origin of adult intestinal stem cells”。论文通讯作者为哥本哈根大学生物技术研究与创新中心的副教授Kim Jensen。Jensen指出,这一发现可能为有效的干细胞治疗铺平道路。
Jensen说道,“我们过去认为细胞变成干细胞的潜力是事先确定的,但是我们的新结果表明所有未成熟细胞在完全发育的器官中变成干细胞的概率是相同的。原则上,这仅是一个在正确的时间出现在正确的地点的问题。来自细胞周围环境的信号决定了它们的命运。如果我们能够鉴定出未成熟细胞发育成干细胞所必需的信号,我们就会更容易在需要的方向上操纵细胞。”
4.Nature:重磅!鉴定出一种独特的肠道干细胞可再生受损肠道
doi:10.1038/s41586-019-1154-y
肠上皮的更替由位于隐窝区底部的多能性LGR5+隐窝基底柱状细胞(crypt-base columnar cell, CBC)驱动。然而,CBC在因辐射等导致的损伤后会丢失,但是肠上皮仍然能够恢复。因此,第二组静止的"+4"细胞,即储备干细胞(reserve stem cell, RSC),已被提出再生受损的肠道。尽管CBC和RSC被认为是相互排斥的,但是随后的研究已发现LGR5+ CBC表达RSC标志物,而且RSC是可有可无的,然而LGR5+细胞对于修复受损的肠道是必需的。此外,人们已发现吸收性肠上皮细胞、分泌细胞和慢循环LGR5+细胞的祖细胞有助于促进再生,相比之下,在肠道再生中起着重要作用的转录调节因子YAP1已被提出诱导LGR5+细胞产生促存活表型。因此,细胞可塑性或不同的细胞群体是否对肠道再生至关重要仍然未知。
在一项新的研究中,来自加拿大西奈山医院、多伦多大学和麦吉尔大学健康中心研究所的研究人员利用单细胞RNA测序分析了再生的小鼠肠道,并鉴定出一种独特的可被损伤激活的静止细胞类型,他们称之为复活干细胞(revival stem cell, revSC)。相关研究结果发表在2019年5月2日的Nature期刊上,论文标题为“Single-cell transcriptomes of the regenerating intestine reveal a revival stem cell”。
revSC以凝聚素(clusterin)高表达为特征,在稳态条件下是非常少见的,但可按照时间层次产生所有主要的肠道细胞类型,包括LGR5+ CBC。在通过辐射、靶向剔除LGR5+ CBC或右旋糖酐硫酸酯钠处理导致肠道受损后,revSC经历一种YAP1依赖性的短暂增殖,重建LGR5+ CBC区室并且是再生功能性肠道所必需的。
5.Stem Cell Rep:科学家鉴别出大脑和肠道干细胞的关键连接
doi:10.1016/j.stemcr.2019.02.011
机体中的器官能够容纳很多干细胞,当机体组织受损、疾病或衰老而无法发挥功能时这些干细胞就会产生再生细胞;近日,一项刊登在国际杂志Stem Cell Reports上的研究报告中,来自罗格斯大学的科学家们通过研究鉴别出了一种新型因子,其对于维持肠道和大脑中干细胞的功能非常重要,该因子的缺失会诱发焦虑、认知障碍甚至胃肠道疾病等。
文章中,研究者揭示了胰岛素样生长因子II基因在大脑和肠道中成体干细胞维持上的重要性,该基因能为肠道中两类功能不同的干细胞提供关键的支持,该基因不受调节的自我更新和增殖则会引发结直肠癌。研究者Steven Levison博士说道,目前研究人员并未完全阐明胰岛素样生长因子II基因在成体干细胞中扮演的关键角色,这种生长因子此前被认为是可有可无的,本文研究则发现,该基因的产物在成体干细胞群体中非常常见。
这种生长因子对于多种类型的成体干细胞非常重要,包括一些对认知功能、嗅觉及组织更新非常关键的成体干细胞等。文章中,研究人员要么5天内非常迅速地要么15天缓慢地移除成年小鼠机体中的胰岛素样生长因子II基因,在肠道中,快速剔除该基因会导致快速循环干细胞(能够补充肠道内壁组织)的快速缺失,从而导致小鼠在一周内体重快速下降及死亡;而缓慢剔除该基因则会使得小鼠通过招募第二种并不活跃的肠道干细胞来得以存活。
6.Nat Cell Biol:揭示Rspo3-Lgr5轴同时调节抗菌防御和胃粘膜再生机制
doi:10.1038/s41556-019-0339-9
由R-spondin(Rspo)与Lgr家族成员结合激活的Wnt信号转导对于胃肠道干细胞更新至关重要。用幽门螺杆菌感染胃部会促进肌成纤维细胞分泌更多的Rspo,从而导致胃腺峡部中Wnt反应性Axin2+Lgr5−干细胞的增殖增加,最终导致胃腺增生。基底Lgr5+细胞也暴露于Rspo3,但是它们作出的反应仍不清楚。
在一项新的研究中,来自德国的研究人员证实与已知的Rspo3具有促有丝分裂活性相反的是,它诱导基底Lgr5+细胞分化为分泌细胞,这些分泌细胞表达intelectin-1等抗菌因子,并将它们分泌到胃腔中。相关研究结果发表在2019年7月的Nature Cell Biology期刊上,论文标题为“R-spondin-3 induces secretory, antimicrobial Lgr5+ cells in the stomach”。
不论是剔除Lgr5+细胞还是敲除肌成纤维细胞中的Rspo3都会导致幽门螺杆菌在包括干细胞区室(即Wnt反应性Axin2+Lgr5−干细胞存在的地方)在内的胃腺中高度定植。相反,在基质中Rspo3的全身给送或过表达可清除胃腺中的幽门螺杆菌。
7.Science:关键蛋白保护机体免受高剂量放疗带来的损伤
doi:10.1126/science.aaq1165
放射疗法是破坏癌细胞和缩小肿瘤体积的最有效方法之一。近几十年来,肠胃肿瘤患者在接受这种治疗之后存活率显著提升。然而,强化放射治疗不仅损害肿瘤细胞,还损害健康的肠细胞,导致60%的治疗患者产生毒性。尽管在放疗结束后观察到毒性逆转,但10%的治疗患者出现胃肠综合征,这是一种以肠细胞死亡为特征的疾病,导致整个肠道破坏和患者死亡。
然而,放射疗法的主要缺点是会造成健康肠道细胞的损伤,从而导致癌症治疗的中断和失败,可能导致肿瘤快速复发。现在,西班牙国家癌症研究中心(CNIO)的科学家在《Science》杂志上发表的一项发现可能有助于保护健康的肠道细胞免受辐射损伤。

该小组的工作重点是一种功能尚未完全理解的蛋白质“URI”。先前的研究发现,某些器官中该蛋白的异常表达水平可导致癌症的发生。最近这项研究表明,高水平的URI蛋白可以保护小鼠免受辐射诱导的肠道损伤,而蛋白质水平过低可以导致胃肠道综合征和死亡。
作者等人开发了第一个遗传小鼠模型来研究这种蛋白质在哺乳动物中的功能。他的团队观察到,在体外细胞培养过程中,高URI水平可保护肠道细胞免受DNA损伤。而体内的效果仍然未知。作者一共开发了三种遗传小鼠模型。其中一个作为对照模型,用于确定URI在肠道中的确切位置;另一种小鼠模型中肠中表达高水平的URI蛋白质,第三种小鼠模型中,基因被敲除以降低肠上皮中的URI水平。
对照小鼠显示URI在位于肠隐窝中的特定休眠干细胞群中表达(称为Lieberkühn的隐窝)。 URI保护这些细胞免受高剂量辐射诱导的毒性。在接受高剂量辐射后,100%设计用于在肠道中表达高水平URI的小鼠在胃肠综合征中存活,而在正常条件下,高达70%的小鼠死亡。相反,所有URI敲除小鼠都死于胃肠道综合征。(生物谷 Bioon.com)
针对肠道干细胞研究近期取得的进展,小编进行了一番盘点,以飨读者。
1.Cell:生酮饮食有益新证据!酮体产生增强肠道干细胞的再生能力
doi:10.1016/j.cell.2019.07.048
在一项新的研究中,来自美国麻省理工学院的研究人员发现了生酮饮食或高脂肪饮食的意外效果:高水平的酮体(ketone body),即脂肪分解产生的分子,有助于肠道维持大量的成体干细胞,这是对于保持肠道内壁健康至关重要。他们还发现即便在没有摄入高脂肪饮食的情形下,肠道干细胞会也产生异常高水平的酮体。这些酮体激活了一种众所周知的称为Notch的信号通路,该通路之前已被证实有助于调节干细胞分化。相关研究结果近期发表在Cell期刊上,论文标题为“Ketone Body Signaling Mediates Intestinal Stem Cell Homeostasis and Adaptation to Diet”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.07.048。
论文通讯作者、麻省理工学院科赫综合癌症研究所成员、生物学副教授Omer Yilmaz说,“酮体是代谢物如何指导肠道干细胞命运的首批例子之一。这些酮体通常被认为在营养压力期间在能量维持中起关键作用,它们通过激活Notch通路来增强干细胞功能。不同营养状态或饮食中酮体水平的变化使得干细胞能够适应不同的生理学条件。”
在这项针对小鼠的研究中,这些研究人员发现,与摄入正常饮食的小鼠体内的肠道干细胞相比,生酮饮食增强肠道干细胞的再生能力,使得它们能够更好地从肠道内壁的损伤中恢复过来。
2.Nature:靶向潘氏细胞产生的Notum可让衰老的肠道干细胞恢复青春
doi:10.1038/s41586-019-1383-0
在一项新的研究中,来自芬兰赫尔辛基大学的研究人员发现随着年龄的增加,肠上皮的再生能力如何发生下降。靶向一种抑制干胞维持信号转导的酶可让老化的肠道恢复再生潜力。这一发现可能指出了缓解年龄相关的胃肠道问题、降低癌症治疗副作用和通过促进康复降低老龄化社会的医疗成本的方法。相关研究结果于2019年7月10日在线发表在Nature期刊上,论文标题为“Notum produced by Paneth cells attenuates regeneration of aged intestinal epithelium”。
年龄引起的组织更新能力下降使得许多常见药物的剂量具有挑战性。靶向一种称为Notum的抑制因子可能提供一种新的方法来增加治疗窗口并促进人口老龄化社会康复。这些研究人员认为除了直接靶向Notum之外,饮食等生活方式因素也可能提供减少Notum因而改善组织更新和修复的方法。
通过使用类器官培养方法,这些研究人员了解到修复组织的干细胞在老化肠道中表现出的功能不良归因于来自邻近的称为潘氏细胞(Paneth cell)的细胞的异常信号。
在正常情形下,肠上皮由依赖于Wnt信号通路活性的干细胞更新。邻近的细胞产生激活这种信号通路的分子。这项新的研究表明,在衰老期间,潘氏细胞开始表达一种分泌性的Wnt抑制剂,即Notum。Notum酶促地让干细胞壁龛(stem cell niche)中的Wnt配体失活,从而降低肠道干细胞的再生潜力。然而,对Notum进行药物抑制可恢复干细胞活性,并且在用一种常用的在肠道中具有严重副作用的化疗药物治疗后促进老年动物的康复。
3.Nature:挑战常规!胎儿中的所有肠道细胞都潜力发育成肠道干细胞
doi:10.1038/s41586-019-1212-5
在一项轰动性的新研究中,来自丹麦哥本哈根大学等研究机构的研究人员反驳了关于干细胞产生的传统观点。他们得出结论:胎儿肠道中的所有细胞都有潜力发育为干细胞。他们揭示出肠道细胞的命运并不是事先确定的,而是由这些细胞的周围环境决定的。这种新的知识可能让人们容易操纵干细胞用于干细胞治疗。相关研究结果于2019年5月15日在线发表在Nature期刊上,论文标题为“Tracing the origin of adult intestinal stem cells”。论文通讯作者为哥本哈根大学生物技术研究与创新中心的副教授Kim Jensen。Jensen指出,这一发现可能为有效的干细胞治疗铺平道路。

图片来自University of Copenhagen。
Jensen说道,“我们过去认为细胞变成干细胞的潜力是事先确定的,但是我们的新结果表明所有未成熟细胞在完全发育的器官中变成干细胞的概率是相同的。原则上,这仅是一个在正确的时间出现在正确的地点的问题。来自细胞周围环境的信号决定了它们的命运。如果我们能够鉴定出未成熟细胞发育成干细胞所必需的信号,我们就会更容易在需要的方向上操纵细胞。”
4.Nature:重磅!鉴定出一种独特的肠道干细胞可再生受损肠道
doi:10.1038/s41586-019-1154-y
肠上皮的更替由位于隐窝区底部的多能性LGR5+隐窝基底柱状细胞(crypt-base columnar cell, CBC)驱动。然而,CBC在因辐射等导致的损伤后会丢失,但是肠上皮仍然能够恢复。因此,第二组静止的"+4"细胞,即储备干细胞(reserve stem cell, RSC),已被提出再生受损的肠道。尽管CBC和RSC被认为是相互排斥的,但是随后的研究已发现LGR5+ CBC表达RSC标志物,而且RSC是可有可无的,然而LGR5+细胞对于修复受损的肠道是必需的。此外,人们已发现吸收性肠上皮细胞、分泌细胞和慢循环LGR5+细胞的祖细胞有助于促进再生,相比之下,在肠道再生中起着重要作用的转录调节因子YAP1已被提出诱导LGR5+细胞产生促存活表型。因此,细胞可塑性或不同的细胞群体是否对肠道再生至关重要仍然未知。
在一项新的研究中,来自加拿大西奈山医院、多伦多大学和麦吉尔大学健康中心研究所的研究人员利用单细胞RNA测序分析了再生的小鼠肠道,并鉴定出一种独特的可被损伤激活的静止细胞类型,他们称之为复活干细胞(revival stem cell, revSC)。相关研究结果发表在2019年5月2日的Nature期刊上,论文标题为“Single-cell transcriptomes of the regenerating intestine reveal a revival stem cell”。
revSC以凝聚素(clusterin)高表达为特征,在稳态条件下是非常少见的,但可按照时间层次产生所有主要的肠道细胞类型,包括LGR5+ CBC。在通过辐射、靶向剔除LGR5+ CBC或右旋糖酐硫酸酯钠处理导致肠道受损后,revSC经历一种YAP1依赖性的短暂增殖,重建LGR5+ CBC区室并且是再生功能性肠道所必需的。
5.Stem Cell Rep:科学家鉴别出大脑和肠道干细胞的关键连接
doi:10.1016/j.stemcr.2019.02.011
机体中的器官能够容纳很多干细胞,当机体组织受损、疾病或衰老而无法发挥功能时这些干细胞就会产生再生细胞;近日,一项刊登在国际杂志Stem Cell Reports上的研究报告中,来自罗格斯大学的科学家们通过研究鉴别出了一种新型因子,其对于维持肠道和大脑中干细胞的功能非常重要,该因子的缺失会诱发焦虑、认知障碍甚至胃肠道疾病等。
文章中,研究者揭示了胰岛素样生长因子II基因在大脑和肠道中成体干细胞维持上的重要性,该基因能为肠道中两类功能不同的干细胞提供关键的支持,该基因不受调节的自我更新和增殖则会引发结直肠癌。研究者Steven Levison博士说道,目前研究人员并未完全阐明胰岛素样生长因子II基因在成体干细胞中扮演的关键角色,这种生长因子此前被认为是可有可无的,本文研究则发现,该基因的产物在成体干细胞群体中非常常见。
这种生长因子对于多种类型的成体干细胞非常重要,包括一些对认知功能、嗅觉及组织更新非常关键的成体干细胞等。文章中,研究人员要么5天内非常迅速地要么15天缓慢地移除成年小鼠机体中的胰岛素样生长因子II基因,在肠道中,快速剔除该基因会导致快速循环干细胞(能够补充肠道内壁组织)的快速缺失,从而导致小鼠在一周内体重快速下降及死亡;而缓慢剔除该基因则会使得小鼠通过招募第二种并不活跃的肠道干细胞来得以存活。
6.Nat Cell Biol:揭示Rspo3-Lgr5轴同时调节抗菌防御和胃粘膜再生机制
doi:10.1038/s41556-019-0339-9
由R-spondin(Rspo)与Lgr家族成员结合激活的Wnt信号转导对于胃肠道干细胞更新至关重要。用幽门螺杆菌感染胃部会促进肌成纤维细胞分泌更多的Rspo,从而导致胃腺峡部中Wnt反应性Axin2+Lgr5−干细胞的增殖增加,最终导致胃腺增生。基底Lgr5+细胞也暴露于Rspo3,但是它们作出的反应仍不清楚。
在一项新的研究中,来自德国的研究人员证实与已知的Rspo3具有促有丝分裂活性相反的是,它诱导基底Lgr5+细胞分化为分泌细胞,这些分泌细胞表达intelectin-1等抗菌因子,并将它们分泌到胃腔中。相关研究结果发表在2019年7月的Nature Cell Biology期刊上,论文标题为“R-spondin-3 induces secretory, antimicrobial Lgr5+ cells in the stomach”。
不论是剔除Lgr5+细胞还是敲除肌成纤维细胞中的Rspo3都会导致幽门螺杆菌在包括干细胞区室(即Wnt反应性Axin2+Lgr5−干细胞存在的地方)在内的胃腺中高度定植。相反,在基质中Rspo3的全身给送或过表达可清除胃腺中的幽门螺杆菌。
7.Science:关键蛋白保护机体免受高剂量放疗带来的损伤
doi:10.1126/science.aaq1165
放射疗法是破坏癌细胞和缩小肿瘤体积的最有效方法之一。近几十年来,肠胃肿瘤患者在接受这种治疗之后存活率显著提升。然而,强化放射治疗不仅损害肿瘤细胞,还损害健康的肠细胞,导致60%的治疗患者产生毒性。尽管在放疗结束后观察到毒性逆转,但10%的治疗患者出现胃肠综合征,这是一种以肠细胞死亡为特征的疾病,导致整个肠道破坏和患者死亡。
然而,放射疗法的主要缺点是会造成健康肠道细胞的损伤,从而导致癌症治疗的中断和失败,可能导致肿瘤快速复发。现在,西班牙国家癌症研究中心(CNIO)的科学家在《Science》杂志上发表的一项发现可能有助于保护健康的肠道细胞免受辐射损伤。

图片来自Nature Cell Biology, 2019, doi:10.1038/s41556-019-0339-9。
该小组的工作重点是一种功能尚未完全理解的蛋白质“URI”。先前的研究发现,某些器官中该蛋白的异常表达水平可导致癌症的发生。最近这项研究表明,高水平的URI蛋白可以保护小鼠免受辐射诱导的肠道损伤,而蛋白质水平过低可以导致胃肠道综合征和死亡。
作者等人开发了第一个遗传小鼠模型来研究这种蛋白质在哺乳动物中的功能。他的团队观察到,在体外细胞培养过程中,高URI水平可保护肠道细胞免受DNA损伤。而体内的效果仍然未知。作者一共开发了三种遗传小鼠模型。其中一个作为对照模型,用于确定URI在肠道中的确切位置;另一种小鼠模型中肠中表达高水平的URI蛋白质,第三种小鼠模型中,基因被敲除以降低肠上皮中的URI水平。
对照小鼠显示URI在位于肠隐窝中的特定休眠干细胞群中表达(称为Lieberkühn的隐窝)。 URI保护这些细胞免受高剂量辐射诱导的毒性。在接受高剂量辐射后,100%设计用于在肠道中表达高水平URI的小鼠在胃肠综合征中存活,而在正常条件下,高达70%的小鼠死亡。相反,所有URI敲除小鼠都死于胃肠道综合征。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


