Cell:重大进展!开发出比CAR-T细胞更安全、用途更广的cCAR-T细胞技术
来源:本站原创 2019-10-25 10:39
2019年10月25日讯/生物谷BIOON/---在一项新的研究中,来自美国格拉斯通研究所和Xyphos生物科学公司(Xyphos Biosciences, Inc.)的研究人员描述了一种攻击被HIV感染的细胞的新技术。这种新技术是CAR-T细胞免疫疗法的一种新的改进版本。近年来,这种疗法因在抵抗血癌上取得的成功而闻名于世。通过改进使得它具有更大的覆盖范围和多功能性,这种称为convertible
2019年10月25日讯/生物谷BIOON/---在一项新的研究中,来自美国格拉斯通研究所和Xyphos生物科学公司(Xyphos Biosciences, Inc.)的研究人员描述了一种攻击被HIV感染的细胞的新技术。这种新技术是CAR-T细胞免疫疗法的一种新的改进版本。近年来,这种疗法因在抵抗血癌上取得的成功而闻名于世。通过改进使得它具有更大的覆盖范围和多功能性,这种称为convertibleCAR T细胞(cCAR-T)的新技术在多个治疗领域显示出了巨大的前景,特别是在抗击HIV方面,这是因为它可以用来缩小在接受抗逆转录病毒疗法(ART)期间HIV感染者体内持续存在的受感染细胞的库存量。相关研究结果于2019年10月24日在线发表在Cell期刊上,论文标题为“Attacking Latent HIV with convertibleCAR-T Cells, a Highly Adaptable Killing Platform”。论文通讯作者为格拉斯通研究所HIV治愈研究中心主任Warner C. Greene博士。
ART可以抑制HIV感染,但不能从宿主中根除这种病毒。一些病毒藏匿在细胞内部,形成了所谓的潜伏性HIV病毒库。在这个藏身之处,一旦患者中断治疗,这种病毒就会重新开始一场致命的感染,从而迫使患者坚持每日服用ART药物的终身治疗方案。
这种潜伏性HIV病毒库是治愈HIV/AIDS的主要障碍。攻击这种病毒库一直是Greene的长期目标。潜伏性HIV病毒库越大,对它的控制就越困难,并且这种病毒在治疗失败后反弹的速度也就越快。
Greene说,“我们的工作重点是缩小这种潜伏性病毒库并设计能够控制变小后的病毒库的免疫反应,从而终止ART治疗。这种‘减少和控制策略(reduce-and-control strategy)’可能导致HIV感染持续缓解或功能性治愈。”
传统的CAR-T细胞技术涉及对一种称为细胞毒性T细胞的免疫细胞进行基因改造,从而在它们的表面上表达一种抗体的精简版本。这种抗体允许细胞毒性T细胞靶向它的靶细胞(比如白血病细胞),并攻击和破坏它们。
但是,对于每种新的病原体或癌细胞,人们必须制造出新的传统CAR-T细胞,并在它们的表面上产生新的靶向抗体。这是耗时耗力的和成本昂贵的。
相比之下,cCAR-T细胞技术使得将细胞毒性T细胞与任意数量的抗体组合使用成为可能。这种特征对于抵抗诸如HIV之类的病原体至关重要,这是因为HIV存在数百种不同的变体。
Greene说,“这种灵活的技术将cCAR-T细胞一次性递送给患者,并让医生能够施用最适合治疗患者疾病(比如HIV/AIDS或白血病)的抗体或抗体混合物。它有潜力彻底引发CAR-T细胞系统变革。”
这样的应用是有前景的,但是还处于开发初期。Greene说:“这项研究是概念验证实验,在该实验中,我们证实可以将一种有前途的抗HIV抗体(称为'广泛中和抗体')与cCAR-T细胞结合起来,从而成功地攻击潜伏性HIV病毒库。”
cCAR-T细胞技术是由Xyphos生物科学公司发明的。作为该公司的首席执行官兼联合创始人James Knighton对此表示赞同。“通过该项目产生的结果为这项技术提供了非凡的验证,并提供了改变当今疾病治疗方式的潜力。”
一种用于攻击可变形敌人的模块化武器
人们已证实传统的CAR-T细胞在诱导血癌(比如淋巴瘤和儿童白血病)缓解方面非常成功。但是作为抵抗HIV感染的疗法,传统的CAR-T细胞并不完美。论文第一作者、Greene实验室科学家Eytan Herzig说,“传统的CAR-T细胞的一些缺点是它们经过基因改造后靶向癌细胞表面上的单个分子,而且一旦被注射到患者体内,无法对它们进行控制。”
HIV非常擅长变形,已知可以逃避每种形式的单药治疗。感染者携带着大量不同的HIV变体。携带单一抗体作为HIV抗击武器的CAR-T细胞不会取得长期成功。
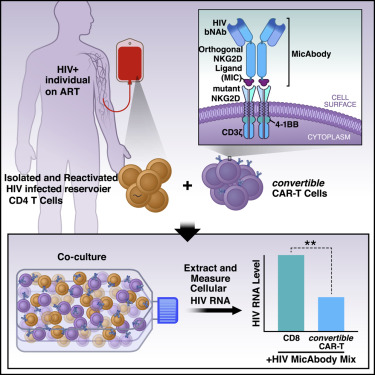
Xyphos生物科学公司通过从细胞毒杀伤细胞中分离出靶向抗体克服了这些缺陷。该公司首席科学家David W. Martin博士解释说:“我们对cCAR-T细胞进行了基因改造,使得这些T细胞可以在其表面上表达受到少量修饰的人类受体蛋白NKG2D。”这种受到修饰的NKG2D受体当与它的搭档结合时,可以将这些T细胞变成有效的杀手。它的搭档是一种叫做MIC-A的蛋白质,Xyphos生物科学公司的科学家对它进行了裁剪和修饰,使得它可以与cCAR-T细胞表面上这种经过修饰的NKG2D受体特异性结合。这些科学家随后将它与靶向抗体的底部融合在一起,从而构建出他们称为MicAbody的产物。因此,这种靶向性MicAbody紧密地和唯一地结合cCAR-T细胞。
Martin继续说:“ MicAbody是一种优雅的解决方案,并且比全新的CAR-T细胞更容易构建和批量生产。”科学家们仅需递送单个cCAR-T细胞并将它与他们选择的MicAbody结合在一起,而无需为每个靶标配备不同的CAR-T细胞。
此外,这种改进后的NKG2D-MicAbody组合提供了一种方便的方式,在需要消除在体内捣乱的CAR-T细胞时提供“自毁开关(kill switch)”,或者在这些细胞在长时间静止后需要被激活时提供“助推开关”。
Martin说:“鉴于它是模块化的,我们认为cCAR-T细胞将比传统的CAR-T细胞更安全,用途更广,并且易于进行外部控制。”
但是,这项技术是否能在血癌之外的领域发挥作用呢?
强大的组合
为了清除潜伏性HIV病毒库,Herzig和Greene一直在实验室中测试称为广泛中和抗体(bNAb)的抗HIV抗体。
Herzig解释说:“它们之所以被称为广泛中和抗体,是因为它们并不仅仅可以中和一种特定的HIV毒株;它们还可以中和大量的HIV毒株。”
但是单靠bNAb不足以杀死感染HIV的细胞。他们需要杀伤性T细胞,而HIV感染患者中存在的问题在于杀伤性T细胞已经耗竭,或者这种潜伏性HIV病毒库含有对这些细胞产生抵抗力的病毒。
Herzig和Greene认为,通过将bNAb和cCAR-T细胞结合在一起,这些细胞就可能获得它们所需的杀伤力。
他们与Xyphos生物科学公司的科学家合作,基于bNAb构建出MicAbody(称为Mic-bNAb),并在各种实验室分析中测试了cCAR-T细胞和Mic-bNAb的组合使用。
在实验室中,Herzig以感染了各种HIV毒株的多种CD4 T细胞(HIV的天然靶标)为研究对象测试了这些组合。特别是,他使用了源自人类扁桃体的细胞制剂;已知在HIV感染者中,扁桃体T细胞是潜伏性HIV病毒库。他想确保cCAR-T/Mic-bNAb组合使用能杀死代表潜伏性HIV病毒库的T细胞类型。
结果是显著的:cCAR-T细胞与Mic-bNAb的组合使用特异性地杀死了受到感染的CD4 T细胞,但未杀死未感染的细胞。它们仅与Mic-bNAb组合使用时才杀死受感染的细胞,然而,不论是单独使用还是与不靶向HIV的MicAbody组合使用都没有这种效果。他们杀死了在实验室中感染了多种HIV毒株的CD4 T细胞。当与靶向HIV的Mic-bNAb和靶向癌细胞的MicAbody组合使用时,cCAR-T细胞可以有效杀死在相同细胞培养物中混合在一起的癌细胞和受到HIV感染的细胞。换句话说,cCAR-T细胞精确地证明了它旨在实现的多功能性和特异性。
最后,Herzig和Greene测试了cCAR-T/Mic-bNAb平台是否可以攻击接受ART治疗的HIV感染者血液中存在的潜伏性HIV病毒库。为了让这些细胞对cCAR-T细胞可见,他们首先用强效的称为“潜伏逆转剂(latency-reversing agent)”的化合物活化这些细胞培养物。在接触后48小时内,一半以上活化的表达HIV靶抗原的细胞被清除。Greene总结道,“这个平台前景广阔。”
展望
但是在这项技术进入临床之前,仍然存在许多障碍。一方面,由于潜伏性HIV病毒库通常对免疫系统是不可见的,因此必须首先激活它以产生bNAb可以观察到并靶向结合的病毒蛋白。作为当前大量存在的可活化潜伏性病毒库细胞的化合物,潜伏期逆转剂包括有效但毒性太大而无法在患者中使用的化学物,也包括安全但作用不强的化合物。
Herzig说:“但是,如果我们能够一次激活5%到10%的潜伏性病毒库,并反复且定期地用装备有MicAbody的cCAR-T细胞杀死它,我们就可以随着时间的推移显著降低这种潜伏性病毒库。”Greene说:“仍然需要更好的活化剂。”
此外,实验室产生的cCAR-T细胞可能会在宿主中触发有害的免疫反应,除非它们源自患者自身的细胞。这是一个成本高昂的主张。Xyphos生物科学公司目前正在探索通用供体细胞,即经过基因修饰后避免攻击患者细胞或者被患者细胞排斥的细胞,这可能导致单个cCAR-T细胞适合于所有患者、所有靶标和多种疾病。
有了这些进展,cCAR-T细胞与bNAb组合使用的前景是不可估量的。Greene说:“cCAR-T细胞技术可能有助于推动HIV感染治愈取得进展,特别是如今在构建通用供体细胞方面取得了巨大进展。这些细胞最终将减少这种方法目前的高昂成本。”
此外,Knighton说,“将单个cCAR-T细胞与多个MicAbody复用的可能性使该平台非常有希望治疗与多种细胞或病原体变体相关的其他疾病,特别是癌症,并避免普遍存在的耐药性问题。”(生物谷 Bioon.com)
参考文献:
1.Eytan Herzig et al. Attacking Latent HIV with convertibleCAR-T Cells, a Highly Adaptable Killing Platform. Cell, 2019, doi:10.1016/j.cell.2019.10.002
2.Researchers adapt CAR-T immunotherapy to target the HIV latent reservoir
https://medicalxpress.com/news/2019-10-car-t-immunotherapy-hiv-latent-reservoir.html

图片来自Cell, 2019, doi:10.1016/j.cell.2019.10.002。
ART可以抑制HIV感染,但不能从宿主中根除这种病毒。一些病毒藏匿在细胞内部,形成了所谓的潜伏性HIV病毒库。在这个藏身之处,一旦患者中断治疗,这种病毒就会重新开始一场致命的感染,从而迫使患者坚持每日服用ART药物的终身治疗方案。
这种潜伏性HIV病毒库是治愈HIV/AIDS的主要障碍。攻击这种病毒库一直是Greene的长期目标。潜伏性HIV病毒库越大,对它的控制就越困难,并且这种病毒在治疗失败后反弹的速度也就越快。
Greene说,“我们的工作重点是缩小这种潜伏性病毒库并设计能够控制变小后的病毒库的免疫反应,从而终止ART治疗。这种‘减少和控制策略(reduce-and-control strategy)’可能导致HIV感染持续缓解或功能性治愈。”
传统的CAR-T细胞技术涉及对一种称为细胞毒性T细胞的免疫细胞进行基因改造,从而在它们的表面上表达一种抗体的精简版本。这种抗体允许细胞毒性T细胞靶向它的靶细胞(比如白血病细胞),并攻击和破坏它们。
但是,对于每种新的病原体或癌细胞,人们必须制造出新的传统CAR-T细胞,并在它们的表面上产生新的靶向抗体。这是耗时耗力的和成本昂贵的。
相比之下,cCAR-T细胞技术使得将细胞毒性T细胞与任意数量的抗体组合使用成为可能。这种特征对于抵抗诸如HIV之类的病原体至关重要,这是因为HIV存在数百种不同的变体。
Greene说,“这种灵活的技术将cCAR-T细胞一次性递送给患者,并让医生能够施用最适合治疗患者疾病(比如HIV/AIDS或白血病)的抗体或抗体混合物。它有潜力彻底引发CAR-T细胞系统变革。”
这样的应用是有前景的,但是还处于开发初期。Greene说:“这项研究是概念验证实验,在该实验中,我们证实可以将一种有前途的抗HIV抗体(称为'广泛中和抗体')与cCAR-T细胞结合起来,从而成功地攻击潜伏性HIV病毒库。”
cCAR-T细胞技术是由Xyphos生物科学公司发明的。作为该公司的首席执行官兼联合创始人James Knighton对此表示赞同。“通过该项目产生的结果为这项技术提供了非凡的验证,并提供了改变当今疾病治疗方式的潜力。”
一种用于攻击可变形敌人的模块化武器
人们已证实传统的CAR-T细胞在诱导血癌(比如淋巴瘤和儿童白血病)缓解方面非常成功。但是作为抵抗HIV感染的疗法,传统的CAR-T细胞并不完美。论文第一作者、Greene实验室科学家Eytan Herzig说,“传统的CAR-T细胞的一些缺点是它们经过基因改造后靶向癌细胞表面上的单个分子,而且一旦被注射到患者体内,无法对它们进行控制。”
HIV非常擅长变形,已知可以逃避每种形式的单药治疗。感染者携带着大量不同的HIV变体。携带单一抗体作为HIV抗击武器的CAR-T细胞不会取得长期成功。
Xyphos生物科学公司通过从细胞毒杀伤细胞中分离出靶向抗体克服了这些缺陷。该公司首席科学家David W. Martin博士解释说:“我们对cCAR-T细胞进行了基因改造,使得这些T细胞可以在其表面上表达受到少量修饰的人类受体蛋白NKG2D。”这种受到修饰的NKG2D受体当与它的搭档结合时,可以将这些T细胞变成有效的杀手。它的搭档是一种叫做MIC-A的蛋白质,Xyphos生物科学公司的科学家对它进行了裁剪和修饰,使得它可以与cCAR-T细胞表面上这种经过修饰的NKG2D受体特异性结合。这些科学家随后将它与靶向抗体的底部融合在一起,从而构建出他们称为MicAbody的产物。因此,这种靶向性MicAbody紧密地和唯一地结合cCAR-T细胞。
Martin继续说:“ MicAbody是一种优雅的解决方案,并且比全新的CAR-T细胞更容易构建和批量生产。”科学家们仅需递送单个cCAR-T细胞并将它与他们选择的MicAbody结合在一起,而无需为每个靶标配备不同的CAR-T细胞。
此外,这种改进后的NKG2D-MicAbody组合提供了一种方便的方式,在需要消除在体内捣乱的CAR-T细胞时提供“自毁开关(kill switch)”,或者在这些细胞在长时间静止后需要被激活时提供“助推开关”。
Martin说:“鉴于它是模块化的,我们认为cCAR-T细胞将比传统的CAR-T细胞更安全,用途更广,并且易于进行外部控制。”
但是,这项技术是否能在血癌之外的领域发挥作用呢?
强大的组合
为了清除潜伏性HIV病毒库,Herzig和Greene一直在实验室中测试称为广泛中和抗体(bNAb)的抗HIV抗体。
Herzig解释说:“它们之所以被称为广泛中和抗体,是因为它们并不仅仅可以中和一种特定的HIV毒株;它们还可以中和大量的HIV毒株。”
但是单靠bNAb不足以杀死感染HIV的细胞。他们需要杀伤性T细胞,而HIV感染患者中存在的问题在于杀伤性T细胞已经耗竭,或者这种潜伏性HIV病毒库含有对这些细胞产生抵抗力的病毒。
Herzig和Greene认为,通过将bNAb和cCAR-T细胞结合在一起,这些细胞就可能获得它们所需的杀伤力。
他们与Xyphos生物科学公司的科学家合作,基于bNAb构建出MicAbody(称为Mic-bNAb),并在各种实验室分析中测试了cCAR-T细胞和Mic-bNAb的组合使用。
在实验室中,Herzig以感染了各种HIV毒株的多种CD4 T细胞(HIV的天然靶标)为研究对象测试了这些组合。特别是,他使用了源自人类扁桃体的细胞制剂;已知在HIV感染者中,扁桃体T细胞是潜伏性HIV病毒库。他想确保cCAR-T/Mic-bNAb组合使用能杀死代表潜伏性HIV病毒库的T细胞类型。
结果是显著的:cCAR-T细胞与Mic-bNAb的组合使用特异性地杀死了受到感染的CD4 T细胞,但未杀死未感染的细胞。它们仅与Mic-bNAb组合使用时才杀死受感染的细胞,然而,不论是单独使用还是与不靶向HIV的MicAbody组合使用都没有这种效果。他们杀死了在实验室中感染了多种HIV毒株的CD4 T细胞。当与靶向HIV的Mic-bNAb和靶向癌细胞的MicAbody组合使用时,cCAR-T细胞可以有效杀死在相同细胞培养物中混合在一起的癌细胞和受到HIV感染的细胞。换句话说,cCAR-T细胞精确地证明了它旨在实现的多功能性和特异性。
最后,Herzig和Greene测试了cCAR-T/Mic-bNAb平台是否可以攻击接受ART治疗的HIV感染者血液中存在的潜伏性HIV病毒库。为了让这些细胞对cCAR-T细胞可见,他们首先用强效的称为“潜伏逆转剂(latency-reversing agent)”的化合物活化这些细胞培养物。在接触后48小时内,一半以上活化的表达HIV靶抗原的细胞被清除。Greene总结道,“这个平台前景广阔。”
展望
但是在这项技术进入临床之前,仍然存在许多障碍。一方面,由于潜伏性HIV病毒库通常对免疫系统是不可见的,因此必须首先激活它以产生bNAb可以观察到并靶向结合的病毒蛋白。作为当前大量存在的可活化潜伏性病毒库细胞的化合物,潜伏期逆转剂包括有效但毒性太大而无法在患者中使用的化学物,也包括安全但作用不强的化合物。
Herzig说:“但是,如果我们能够一次激活5%到10%的潜伏性病毒库,并反复且定期地用装备有MicAbody的cCAR-T细胞杀死它,我们就可以随着时间的推移显著降低这种潜伏性病毒库。”Greene说:“仍然需要更好的活化剂。”
此外,实验室产生的cCAR-T细胞可能会在宿主中触发有害的免疫反应,除非它们源自患者自身的细胞。这是一个成本高昂的主张。Xyphos生物科学公司目前正在探索通用供体细胞,即经过基因修饰后避免攻击患者细胞或者被患者细胞排斥的细胞,这可能导致单个cCAR-T细胞适合于所有患者、所有靶标和多种疾病。
有了这些进展,cCAR-T细胞与bNAb组合使用的前景是不可估量的。Greene说:“cCAR-T细胞技术可能有助于推动HIV感染治愈取得进展,特别是如今在构建通用供体细胞方面取得了巨大进展。这些细胞最终将减少这种方法目前的高昂成本。”
此外,Knighton说,“将单个cCAR-T细胞与多个MicAbody复用的可能性使该平台非常有希望治疗与多种细胞或病原体变体相关的其他疾病,特别是癌症,并避免普遍存在的耐药性问题。”(生物谷 Bioon.com)
参考文献:
1.Eytan Herzig et al. Attacking Latent HIV with convertibleCAR-T Cells, a Highly Adaptable Killing Platform. Cell, 2019, doi:10.1016/j.cell.2019.10.002
2.Researchers adapt CAR-T immunotherapy to target the HIV latent reservoir
https://medicalxpress.com/news/2019-10-car-t-immunotherapy-hiv-latent-reservoir.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


