**腱鞘巨细胞瘤药物批准上市 且看靶点CSF1R竞争格局
来源:药渡 2019-10-17 12:20
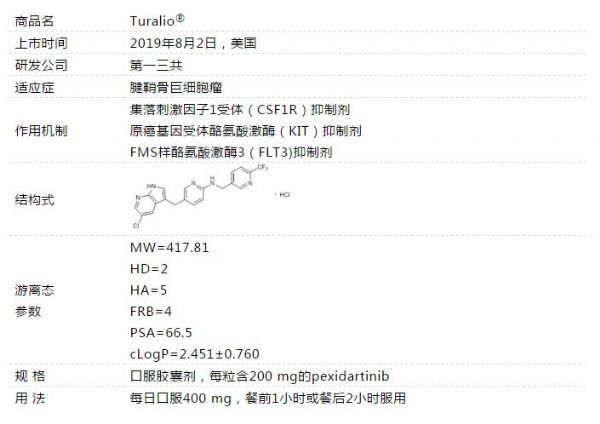
2019年8月2日获美国食品药品监督管理局(FDA)批准Pexidartinib上市,用于治疗功能受限且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者。Pexidartinib是该疾病的首款获批药物。Pexidartinib是一种集落刺激因子1受体(CSF1R)抑制剂,开发该靶点的领头企业有辉瑞、诺华等,代表药物有苹果酸舒尼替尼等,CSF1R药物2018年的销售额接近两亿美元.
2019年8月2日获美国食品药品监督管理局(FDA)批准Pexidartinib上市,用于治疗功能受限且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者。Pexidartinib是该疾病的首款获批药物。Pexidartinib是一种集落刺激因子1受体(CSF1R)抑制剂,开发该靶点的领头企业有辉瑞、诺华等,代表药物有苹果酸舒尼替尼等,CSF1R药物2018年的销售额接近两亿美元......
关于Pexidartinib
Pexidartinib是一种新型口服小分子,2019年1月12日,美国肿瘤协会将Pexidartinib评定为治疗罕见疾病的五大进展之一。2014年,美国FDA授予Pexidartinib治疗腱鞘巨细胞瘤的孤儿药资格,2015年,欧盟授予其孤儿药资格。
腱鞘巨细胞瘤是一种罕见的良性软组织肿瘤,又名色素结节性腱鞘炎(PVNS)或鞘膜巨细胞瘤(GCT-TS),引起关节或肢体肿胀、疼痛、僵硬和活动度下降。据估计[1],TGCT的发病率为每年百万分之十一至五十。
目前,手术切除是腱鞘巨细胞瘤的标准护理方法。然而,复发型、难治型腱鞘巨细胞瘤患者的肿瘤包裹在骨头、腱、韧带和关节等外周部位,因此肿瘤很难通过手术清除;病情严重患者可能面临手术带来的关节功能受损的风险;况且不是所有的腱鞘巨细胞瘤患者都适合手术治疗。即使如此,手术也存在高致死风险或高复发率的缺点,弥漫型病例的复发率估计高达15%[2,3,4,5]。
Lacnotuzumab是目前唯一的腱鞘巨细胞瘤在研药物,门可罗雀。
靶点信息
腱鞘巨细胞瘤由集落刺激因子1(CSF1)的过度表达而引起。CSF1是一种由二硫键连接而成的二聚体糖蛋白,主要存在于骨髓腔内,负责巨噬细胞的生长、增殖和分化等细胞过程。CSF1R作为CSF1和IL34的细胞表面受体在调节造血前体的存活、增殖和分化中起重要作用。CSF1与CSF1R形成的信号轴在多种恶性肿瘤如乳腺癌、卵巢癌、鼻咽癌等中异常表达,与肿瘤的发生发展密切相关。
KIT是酪氨酸激酶受体蛋白家族的重要成员之一,其作为干细胞因子的受体,通过一系列信号通路参与造血干细胞的增殖分化过程。
FLT3也称为胎肝激酶2(FLK-2)和人干细胞激酶1(STK-1),是Ⅲ型受体酪氨酸激酶(RTKⅢ)家族成员之一。FLT3与其他RTKⅢ家族成员包括CSF1R或FMS、血小板衍化生长因子(PDGFR)、KIT等基因序列非常相似,其蛋白结构均包括5个Ig样结构域组成的胞外区、一个跨膜区、一个近膜区以及胞内由激酶插入区分隔而成的两个酪氨酸激酶区。
Pexidartinib通过与CSF1R的近膜区域相互作用来刺激CSF1R的自身抑制状态,并阻止CSF1和ATP与该区域结合,其中CSF1R负责激酶域的折叠和失活。CSF1与受体不结合的话CSF1R不能进行配体诱导的自磷酸化。
Pexidartinib通过抑制CSF1R信号通路来达到抑制肿瘤细胞增殖的目的,并下调与疾病相关的细胞,如巨噬细胞。Pexidartinib还抑制KIT和FLT3,二者均是受体酪氨酸激酶,负责调节细胞增殖和存活等关键细胞过程。
经查询药渡数据库,截至目前(2019年10月12日),CSF1R上市药物有5款,在研药物有15款(化学药物9款,生物药6款),主要集中在肿瘤治疗领域,尤其肾癌和胰腺癌。
Vorolanib的研发目标是保留辉瑞舒尼替尼的药效,并大幅度低毒性。Vorolanib在中国的开发权于2009年被授权予卡南吉医药,并将在中国以外的全球研发权和商业化权利授权给Equinox Science。2018年6月,Equinox Science成为贝达的全资子公司,至此,贝达药业通过卡南吉拥有Vorolanib化合物全部适应症的国内权益。贝达子公司美国Xcovery也在开展此药的临床研究。在中国,Vorolanib治疗湿性年龄相关性黄斑变性的研究处于临床II期。
SOMCL-15-290是FGFR/KDR(VEGFR2)/CSF1R多靶点抑制剂,最初由中国科学院上海药物研究所研发,后转让给石药集团。
Cabiralizumab最初由Five Prime Therapeutics开发,2015年百时美施贵宝公司获得了该药物的全球研发和商业化授权。2016年,Cabiralizumab被美国FDA认证为治疗腱鞘巨细胞瘤的孤儿药。
药渡观点
Pexidartinib作为治疗腱鞘巨细胞瘤的第一款批准药物,很大程度上弥补了手术治疗的不足之处,为这类患者,尤其关节功能受限且不适合手术改善的症状性腱鞘巨细胞瘤患者带来了新的治疗选择。步其后尘的是诺华开发的Lacnotuzumab,腱鞘巨细胞瘤药物门可罗雀。因此,制药公司应当增加在腱鞘巨细胞瘤领域的研发投入,开发更多更有效的腱鞘巨细胞瘤药物,为这类患者带来更多的治疗选择。国内该疾病的探索处于空白,本土企业面临更大的机遇和挑战。
CSF1与CSF1R信号通路与肿瘤的发生发展密切相关,因此,该靶点也是抗癌药物布局的重要方向。CSF1R在研药物不在少数,目前,国内该靶点药物仅有三款,占全球的20%,Vorolanib处于治疗肾癌的临床II/III期研究,暂时保持国内领先位置。与其说国内CSF1R研发有一定的成果,倒不如说有更大的发展空间。但是,我们相信,星星之火可以燎原,该靶点药物研发将会收获越来越好的结果。(生物谷Bioon.com)
小编推荐会议 2019无锡国际生物医药论坛暨第九届Cell Death & Disease国际研讨会-新药研发
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。