Nature:揭示蛋白BORIS是耐药性癌症产生的罪魁祸首
来源:本站原创 2019-10-08 13:06
2019年10月8日讯/生物谷BIOON/---在一项新的研究中,美国研究人员发现一种称为BORIS的蛋白是某些儿童癌症的罪魁祸首。这种蛋白能够破解神经母细胞瘤基因组,导致在某些类型的治疗后处于休眠状态的癌细胞苏醒过来,从而引起癌症复发。他们还发现这种蛋白与其他几种癌症中的耐药性相关。相关研究结果近期发表在Nature期刊上,论文标题为“BORIS promotes chromatin regul
2019年10月8日讯/生物谷BIOON/---在一项新的研究中,美国研究人员发现一种称为BORIS的蛋白是某些儿童癌症的罪魁祸首。这种蛋白能够破解神经母细胞瘤基因组,导致在某些类型的治疗后处于休眠状态的癌细胞苏醒过来,从而引起癌症复发。他们还发现这种蛋白与其他几种癌症中的耐药性相关。相关研究结果近期发表在Nature期刊上,论文标题为“BORIS promotes chromatin regulatory interactions in treatment-resistant cancer cells”。论文通信作者为达纳-法伯癌症研究所/波士顿儿童医院的Rani George博士。
产生耐药性
当细胞需要开启特定基因时,包裹我们DNA的长长的染色质纤维会形成环状结构。这些染色质环状结构让基因启动子和基因增强子靠得很近,从而使得一个基因或一组基因得以开启和表达。这项研究发现,在神经母细胞瘤中,BORIS形成并锚定了新的环状结构,同时开启了许多基因,但不是以一种好的方式。
George说,“它调节着耐药性神经母细胞瘤细胞存活的基因的表达。”
儿童癌症可能特别容易受到BORIS作用的影响。与成人癌症不同的是,它们很少是由DNA突变引起的。相反,它们通常是由于表观遗传影响而产生的,包括改变染色质环状结构并对重要基因的表达进行修饰的因素。表观遗传因素也有助于耐药性的产生。
探究神经母细胞瘤耐药性
George和他的同事们开始用抑制基因ALK发生的一种已知的可靶向突变的药物处理人类神经母细胞瘤细胞,直到这些癌细胞对ALK抑制剂产生耐药性为止。这些耐药性癌细胞具有增加的癌基因MYCN拷贝。作为一种癌基因,MYCN有助于驱动神经母细胞瘤、预示预后不良,但是它是不能直接靶向的。
为了更好地理解这种耐药性的产生,这些研究人员随后对药物敏感的、部分耐药性和完全耐药性的神经母细胞瘤细胞进行了单细胞RNA测序,以查看每种细胞状态下哪些基因开启和关闭。
他们发现当用ALK抑制剂处理这些癌细胞时,有一些癌细胞退化到一种更为原始的状态,表达了许多自我更新因子。在这种状态下保持休眠一段时间后,它们开始苏醒和增殖。这正是BORIS出现的时候。
发现BORIS
RNA测序表明从休眠状态苏醒并又开始增殖的癌细胞正在产生大量的BORIS。这些癌细胞仍然携带ALK突变,并具有增加的MYCN癌基因拷贝。但是,这种癌症不再需要这些来生长。
George说:“这些癌细胞已经进化出完全不同的表型。它们与原始的神经母细胞瘤细胞完全不同。突变的ALK基因在蛋白水平上不表达,而且即使这些癌细胞中有50到100个MYCN癌基因拷贝,但是它们也不表达。”
相反,在BORIS的驱动下,这些癌细胞表达了许多通常在早期神经组织中观察到的因子。
George说,“我们发现神经母细胞瘤中BORIS的过度表达与患者预后不良有关。”
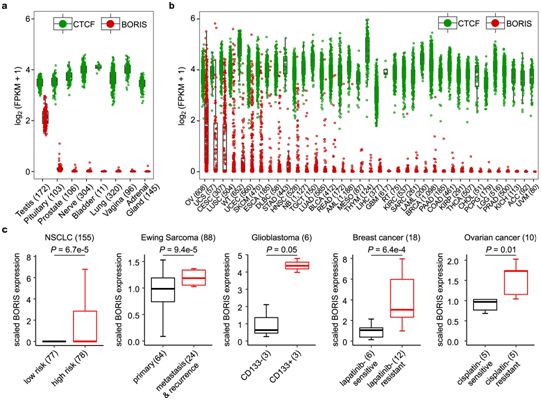
这些研究人员继续研究其他癌症中的基因表达。在尤文肉瘤、胶质母细胞瘤、非小细胞肺癌、乳腺癌和卵巢癌中,复发性的耐药癌症中的BORIS表达高于低风险的癌症。
George和她的同事们如今开始寻找靶向BORIS的方法。这项研究提供了线索:鉴于一种称为BRD4的蛋白与BORIS一起促进基因表达,抑制BRD4蛋白可以抑制表达BORIS的神经母细胞瘤生长,而且这种抑制程度要大于不表达BORIS的神经母细胞瘤。
好比侦探案件
乍看之下,BORIS似乎并不是一种可能的癌症靶标。在正常情形下,它仅在胚胎发育过程中表达,随后仅在睾丸和卵巢细胞中发现。但是,在越来越多的研究中,它突然出现了,从而引发了有关它发挥什么作用的问题。
George说:“我们发现了BORIS的一种以前未知的作用。”她是侦探小说的狂热读者,她将自己团队的研究比作法医调查。她说:“你从未怀疑的人可能就是罪魁祸首。那么,你的责任就是向由你的同行组成的科学‘陪审团’证实你的观点。”
尽管染色质环状结构的形成是出乎意料之外的,但是这项研究提供了新的线索,这些线索可能会在未来带来丰厚的回报。(生物谷 Bioon.com)
参考资料:
1.David N. Debruyne et al. BORIS promotes chromatin regulatory interactions in treatment-resistant cancer cells. Nature, 2019, doi:10.1038/s41586-019-1472-0.
2.Meet BORIS: Possible new culprit in drug-resistant cancer
https://medicalxpress.com/news/2019-09-boris-culprit-drug-resistant-cancer.html

图片来自Nature, 2019, doi:10.1038/s41586-019-1472-0。
产生耐药性
当细胞需要开启特定基因时,包裹我们DNA的长长的染色质纤维会形成环状结构。这些染色质环状结构让基因启动子和基因增强子靠得很近,从而使得一个基因或一组基因得以开启和表达。这项研究发现,在神经母细胞瘤中,BORIS形成并锚定了新的环状结构,同时开启了许多基因,但不是以一种好的方式。
George说,“它调节着耐药性神经母细胞瘤细胞存活的基因的表达。”
儿童癌症可能特别容易受到BORIS作用的影响。与成人癌症不同的是,它们很少是由DNA突变引起的。相反,它们通常是由于表观遗传影响而产生的,包括改变染色质环状结构并对重要基因的表达进行修饰的因素。表观遗传因素也有助于耐药性的产生。
探究神经母细胞瘤耐药性
George和他的同事们开始用抑制基因ALK发生的一种已知的可靶向突变的药物处理人类神经母细胞瘤细胞,直到这些癌细胞对ALK抑制剂产生耐药性为止。这些耐药性癌细胞具有增加的癌基因MYCN拷贝。作为一种癌基因,MYCN有助于驱动神经母细胞瘤、预示预后不良,但是它是不能直接靶向的。
为了更好地理解这种耐药性的产生,这些研究人员随后对药物敏感的、部分耐药性和完全耐药性的神经母细胞瘤细胞进行了单细胞RNA测序,以查看每种细胞状态下哪些基因开启和关闭。
他们发现当用ALK抑制剂处理这些癌细胞时,有一些癌细胞退化到一种更为原始的状态,表达了许多自我更新因子。在这种状态下保持休眠一段时间后,它们开始苏醒和增殖。这正是BORIS出现的时候。
发现BORIS
RNA测序表明从休眠状态苏醒并又开始增殖的癌细胞正在产生大量的BORIS。这些癌细胞仍然携带ALK突变,并具有增加的MYCN癌基因拷贝。但是,这种癌症不再需要这些来生长。
George说:“这些癌细胞已经进化出完全不同的表型。它们与原始的神经母细胞瘤细胞完全不同。突变的ALK基因在蛋白水平上不表达,而且即使这些癌细胞中有50到100个MYCN癌基因拷贝,但是它们也不表达。”
相反,在BORIS的驱动下,这些癌细胞表达了许多通常在早期神经组织中观察到的因子。
George说,“我们发现神经母细胞瘤中BORIS的过度表达与患者预后不良有关。”
这些研究人员继续研究其他癌症中的基因表达。在尤文肉瘤、胶质母细胞瘤、非小细胞肺癌、乳腺癌和卵巢癌中,复发性的耐药癌症中的BORIS表达高于低风险的癌症。
George和她的同事们如今开始寻找靶向BORIS的方法。这项研究提供了线索:鉴于一种称为BRD4的蛋白与BORIS一起促进基因表达,抑制BRD4蛋白可以抑制表达BORIS的神经母细胞瘤生长,而且这种抑制程度要大于不表达BORIS的神经母细胞瘤。
好比侦探案件
乍看之下,BORIS似乎并不是一种可能的癌症靶标。在正常情形下,它仅在胚胎发育过程中表达,随后仅在睾丸和卵巢细胞中发现。但是,在越来越多的研究中,它突然出现了,从而引发了有关它发挥什么作用的问题。
George说:“我们发现了BORIS的一种以前未知的作用。”她是侦探小说的狂热读者,她将自己团队的研究比作法医调查。她说:“你从未怀疑的人可能就是罪魁祸首。那么,你的责任就是向由你的同行组成的科学‘陪审团’证实你的观点。”
尽管染色质环状结构的形成是出乎意料之外的,但是这项研究提供了新的线索,这些线索可能会在未来带来丰厚的回报。(生物谷 Bioon.com)
参考资料:
1.David N. Debruyne et al. BORIS promotes chromatin regulatory interactions in treatment-resistant cancer cells. Nature, 2019, doi:10.1038/s41586-019-1472-0.
2.Meet BORIS: Possible new culprit in drug-resistant cancer
https://medicalxpress.com/news/2019-09-boris-culprit-drug-resistant-cancer.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


