CAR-T细胞疗法研究进展(第9期)
来源:本站原创 2019-09-30 23:59
2019年9月30日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程
2019年9月30日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Science子刊:重大进展!新型CAR-T细胞疗法有望克服血癌复发
doi:10.1126/scitranslmed.aaw9414
在一项新的研究中,来自中国四川大学华西医院、郑州大学第一附属医院、大连医科大学附属第二医院、美国希望之城、南加州大学和威尔康乃尔医学院的研究人员报道首个靶向癌细胞上表达的B细胞活化因子受体(B cell activating factor receptor, BAFF-R)的CAR-T细胞根除了动物模型中对CD19靶向疗法产生抵抗性的人白血病细胞和淋巴瘤细胞。这种新疗法将于明年在临床试验中用于治疗对在接受CD19免疫疗法治疗后出现癌症复发的患者,并有可能用作一线的CAR-T细胞免疫疗法。相关研究结果发表在2019年9月25日的Science Translational Medicine期刊上,论文标题为“CAR T cells targeting BAFF-R can overcome CD19 antigen loss in B cell malignancies”。论文通讯作者为希望之城综合癌症中心副主任Larry Kwak博士。论文第一作者为希望之城血液学与造血细胞移植系教授Hong Qin博士。
据估计有20%至30%的在接受CD19 CAR-T细胞治疗后获得病情缓解的白血病患者和淋巴瘤患者将在几年后出现癌症复发。这些靶向癌性B细胞表面上表达的CD19蛋白的CAR-T细胞的功效开始减弱,因此癌症就复发了。
在这项新的研究中,携带CD19治疗抗性的人类肿瘤(包括伯基特淋巴瘤、套细胞淋巴瘤和其他的非霍奇金淋巴瘤亚型,以及急性淋巴细胞白血病)的动物模型接受了BAFF-R CAR-T细胞治疗。在接受这些CAR-T细胞治疗后,他们观察到明显的肿瘤消退和延长的生存期。在携带人类伯基特淋巴瘤的动物模型中,它们在接受单次BAFF-R CAR-T治疗后即可治愈(肿瘤完全消退,长期生存率100%)。在这项研究的另一部分中,动物模型具有CD19阳性人类肿瘤和CD19阴性人类肿瘤的混合群体。然后,它们接受CD19 CAR-T细胞疗法或BAFF-R CAR-T细胞疗法;BAFF-R CAR-T细胞能够根除这两种肿瘤群体,而在接受CD19 CAR-T细胞治疗的动物模型中,这种治疗失败了。
这些研究人员还研究了来自在接受CD19靶向免疫治疗药物博纳吐单抗治疗后出现癌症复发的患者的肿瘤样本。这项研究证实BAFF-R CAR-T细胞始终如一地有效地抵抗这些肿瘤,然而,相比于治疗前的样本,CD19 CAR-T细胞对每个患者复发性肿瘤的反应大大减少。
2.Nat Med:CAR-T细胞疗法处于“免疫治疗革命”的风口浪尖
doi:10.1038/s41591-019-0564-6
在一篇新的综述文章中,美国斯坦福大学医学中心的Robbie Majzner博士和Crystal Mackall博士总结道,对免疫系统在控制癌症中作用的更深入理解有助于推动“免疫治疗革命”,并且为许多患上先前无法治愈的癌症的患者(包括儿童患者)带来了希望。这篇文章发表在2019年9月的Nature Medicine期刊上,文章标题为“Clinical lessons learned from the first leg of the CAR T cell journey”。
CAR-T细胞疗法是一种针对血液癌症的癌症疗法。这种单次灌注治疗依靠患者自身的免疫系统细胞来抵抗癌症。在2000年代初期开展的初步实验室测试以及随后的数百项临床试验表明从免疫系统招募重要的免疫细胞可以以高度个性化的方式抗击癌症。CAR-T细胞疗法涉对T细胞进行基因修饰,仅是越来越多的癌症免疫疗法中的一种,这些疗法表明免疫系统的成分如何可以被有益地利用。
两种CAR-T细胞药物已获得美国食品药物管理局(FDA)的批准:诺华公司的产品Kymriah(通用名tisaglenlecleucel)于2017年8月获得批准,随后在同年10月Yescarta(通用名axicabtageneciloleucel)获得批准。Yescarta由美国吉利德科学公司(Gilead Sciences)旗下子公司Kite制药公司(Kite Pharmaceuticals)开发。Kymriah用于治疗25岁或以下的患有对先前疗法无反应的急性B淋巴细胞性白血病(B-ALL)的患者。Yescata的目标人群是患有对常规治疗无反应的B细胞癌的成年患者。
正如Majzner和Mackall在他们的分析中强调的那样,CAR-T细胞疗法与任何形式的癌症治疗一样极其复杂。一些患者对这种灌注疗法有很强的反应;其他人则会发生癌症复发。Majzner和Mackall认为,某些形式的癌症,特别是实体瘤,对CAR-T细胞疗法的反应不如血液癌症好,但是当前的与CAR-T细胞疗法相关的弊病可能不会持续到将来。
Majzner和Mackall报道,“疾病组织学已成为影响CAR-T细胞治疗结果的主要因素。尽管在实体瘤中CAR-T细胞的治疗结果还不那么强大,但是在人体试验中表现出的临床疗效的一些早期迹象暗示了即将来临的成功。对影响反应和抵抗性的因素的进一步理解正在推动下一代CAR-T细胞疗法的开发,从而有望在血液癌症和实体瘤中实现更高的疗效。”
3.Science子刊:驯服细胞因子怪兽!揭示T细胞激活疗法中毒性细胞因子释放机制
doi:10.1126/scitranslmed.aax8861
经基因改造后结合癌细胞抗原并激活T细胞杀死癌细胞的双特异性抗体显示出临床前景。不幸的是,由于不受控制的免疫激活和细胞因子释放,它们也可能引起严重的毒副作用。无论采用哪种方式,T细胞激活疗法通常都会伴随全身性细胞因子释放,这可能会进展为致命性的细胞因子释放综合征(CRS),即细胞因子风暴。鉴于在机制上对T细胞激活和全身性细胞因子释放之间的关系的不完全理解,人们尚不清楚如何实现保留全部治疗潜力的最佳毒性管理。
在一项新的研究中,来自美国基因泰克公司的研究人员报道了将CD3双特异性抗体介导的杀伤与毒性细胞因子释放相关联在一起的细胞类型特异性的细胞机制。这种免疫级联反应是由T细胞触发引起的,然而单核细胞和巨噬细胞是全身毒性细胞因子释放的主要来源。他们证实T细胞产生的肿瘤坏死因子α(TNF-α)是CD3双特异性抗体治疗后介导单核细胞激活和全身性细胞因子释放的主要机制。相关研究结果发表在2019年9月4日的Science Translational Medicine期刊上,论文标题为“CD3 bispecific antibody–induced cytokine release is dispensable for cytotoxic T cell activity”。
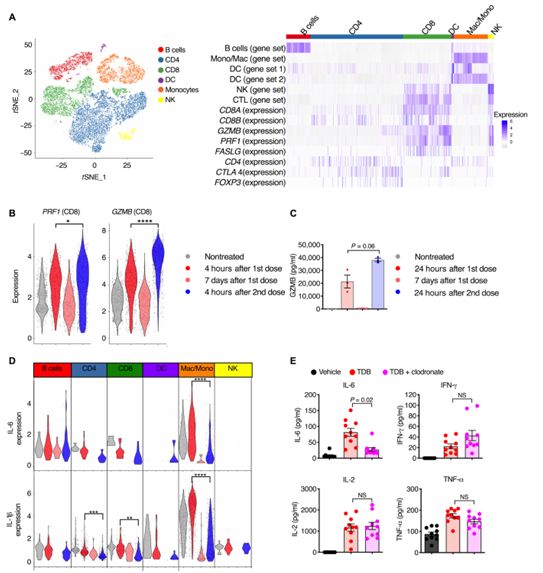
阻止TNF-α释放足以在不影响抗肿瘤效果的同时破坏单核细胞细胞因子的全身性释放。仅在最初暴露于CD3双特异性抗体时才观察到全身性细胞因子释放,而在后续的CD3双特异性抗体剂量暴露中则观察不到,这表明剂量之间存在生物学差异。尽管第二次暴露后细胞因子释放受损,但T细胞的细胞毒性仍然不受影响,这表明在不释放细胞因子的情况下可以实现T细胞的细胞溶解活性。在CD3双特异性抗体存在的情形下,毒性细胞因子与T细胞的细胞溶解活性在机制上的解偶联为临床上探索减轻毒性的预防性治疗方法提供了生物学依据。这项新的研究为在未来通过进一步改进CAR-T细胞免疫疗法降低细胞因子释放综合征同时确保它的抗肿瘤免疫反应不受影响奠定了基础。
4.Science子刊:抑制抗原非依赖性信号转导可降低CAR-T细胞的毒副作用
doi:10.1126/scisignal.aax1872
在一项新的研究中,来自英国和美国的研究人员发现利用时程质谱流式细胞技术(time course mass cytometry)进行的单细胞分析提供了一种快速地评估CAR-T细胞活化的方法。他们发现在CAR-T细胞增殖期间,增加αβ T细胞数量的过程足以增加αβ T细胞中抗原非依赖性信号转导。相反之下,γδT细胞增殖并不改变它们的基础活性。当这些γδT细胞经基因改造后表达嵌合共刺激受体(chimeric costimulatory receptor, CCR)时,它们特异性地识别发生转化的骨髓细胞,但不能识别健康的骨髓细胞。这些数据展示了一种设计特异性抗肿瘤反应的策略,可避免与抗原非依赖性信号转导相关的并发症。相关研究结果发表在2019年9月10日的Science Signaling期刊上,论文标题为“Engineering γδT cells limits tonic signaling associated with chimeric antigen receptors”。
他们比较了发生增殖的T细胞和经转导表达第二代CAR的T细胞中的信号转导,结果发现T细胞增殖增强了对刺激作出的反应。然而,这种细胞增殖也诱导抗原非依赖性信号转导和下降的T细胞信号转导网络可塑性,这与T细胞衰竭(T cell exhaustion)标志物PD-1和TIM-3的表达相关。
鉴于这一点在CD3ζ下游的通路中最为明显,他们对表达缺乏CD3ζ但含有DAP10刺激结构域的嵌合共刺激受体(chimeric costimulatory receptor, CCR)的γδT细胞进行了类似的分析。这些CCR-γδT细胞并未显示出抗原非依赖性信号转导,但是在存在CCR特异性刺激或同源白血病细胞的情况下可被有效激活并产生细胞毒性反应。
单细胞信号分析可以对CAR-T和CCR-T细胞激活进行详细表征,以更好地了解它们的功能活性。此外,他们证实在髓系恶性肿瘤中,CCR-γδT细胞可能具有避免脱靶毒性作用和同种异体反应性的潜力。
5.Nat Med:临床试验表明新型CAR-T细胞疗法有望更安全地治疗急性淋巴细胞白血病
doi:10.1038/s41591-019-0549-5
在一项新的临床研究中,来自英国伦敦大学学院(UCL)的Persis Amrolia教授、Sara Ghorashian博士及其团队开发出一种旨在更快靶向癌细胞并导致更少副作用的新型CAR-T细胞疗法。这种方法在治疗以前无法治愈的急性淋巴细胞白血病(ALL)患儿方面提供非常有前景的结果。相关研究结果发表在2019年9月的Nature Medicine期刊上,论文标题为“Enhanced CAR T cell expansion and prolonged persistence in pediatric patients with ALL treated with a low-affinity CD19 CAR”。 在这项称为CARPALL的临床试验中,他们在患有复发性ALL的儿童和青年人中测试了这种新型的CAR-T细胞疗法。
在CAR T细胞疗法中,称为T细胞的免疫细胞经基因改造后在它们的表面上含有称为嵌合抗原受体(CAR)的分子,因而能够特异性地识别癌细胞。比如,在这种方法中,患者自身的T细胞经过基因改造后含有一种称为CAT-19的新型CAR分子,这种新型CAR分子是由UCL癌症研究所的Martin Pule博士实验室开发的。
这些经过基因改造的CAR-T细胞用于治疗大欧蒙街儿童医院(GOSH)、曼彻斯特儿童医院和伦敦大学医院的14例复发性ALL患者。这些研究人员发现在接受这种CAR-T细胞治疗后,其中的12名患有无法治愈ALL的患者在3个月后清除了他们所患的疾病并且5名患者仍然保持无白血病状态。患者也经历了更少的称为细胞因子释放综合征(CRS)的有害副作用。
6.Nature:重大进展!除了治疗癌症之外,CAR-T细胞还有望用于治疗心脏病
doi:10.1038/s41586-019-1546-z
CAR-T细胞疗法是一种快速出现的免疫疗法,使用患者自身的T细胞来治疗某些类型的癌症。它也可能是另一种危及生命的疾病---心脏病---的可行治疗选择。在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员使用经过基因修饰的T细胞来靶向和移除促进心肌纤维化(cardiac fibrosis)---一种在大多数心脏病类型中发现的导致心脏僵硬和心脏功能下降的瘢痕形成过程---产生的活化成纤维细胞(activated fibroblast)。他们发现在由高血压引起心脏病的小鼠中,这种细胞疗法显著降低心肌纤维化并恢复心脏功能。相关研究结果于2019年9月11日在线发表在Nature期刊上,论文标题为“Targeting cardiac fibrosis with engineered T cells”。
论文通讯作者、宾夕法尼亚大学佩雷尔曼医学院执行副院长Jonathan A. Epstein博士说,“利用患者自身的细胞来对抗癌症的能力一直是过去十年最有前景的研究突破之一,我们很高兴能找到利用这种相同的技术治疗其他常见疾病的方法。虽然在我们将这种方法引入临床环境之前还需开展更多的研究,但是这标志着我们在治疗---潜在地逆转---一种加快心力衰竭进展的病症的研究工作中迈出重要一步。”
7.研究开发超级免疫细胞!
新闻来源:Super-powered immune cells
一项一期临床试验将测试的CAR-T细胞可行性和安全性,这是一种修改从病人自身的血液获得的T细胞使之具有独特的能力来直接攻击和杀死癌细胞的先进的癌症治疗策略癌症,包括小细胞肺癌肉瘤和三阴性乳腺癌。新的临床试验将使研究人员更多地了解CAR-T细胞如何与实体肿瘤相互作用,希望这种基于免疫的疗法有一天能治疗多种不同的癌症。这项试验由南澳大利亚大学癌症生物研究中心(center for Cancer biologology)领导,该中心是南澳大利亚大学(University of South Australia)、阿德莱德中央地方卫生网络(CALHN)和阿德莱德皇家医院(Royal Adelaide Hospital)的联盟。
负责制造CAR-T细胞产品并跟踪患者治疗反应的研究科学家是南澳大利亚大学的Tessa Gargett博士,她是癌症生物学中心的研究员。她说CAR-T免疫疗法显示出发展癌症治疗的巨大潜力。
"嵌合抗原受体(CAR) T细胞是癌症免疫治疗领域一项很有前途的新技术。从本质上讲,CAR-T细胞是一种超强的免疫细胞,它的工作原理是招募并增强患者免疫系统攻击肿瘤的能力。他们在治疗某些形式的化疗耐药血癌方面取得了令人震惊的结果,但在治疗实体癌症方面还没有取得类似的突破--这就是这项研究的切入点。"Gargett博士说。
8.Cell:操纵干扰素信号有望让癌症免疫疗法变得有效
doi:10.1016/j.cell.2019.07.019
在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现一种能够告诉免疫系统抵抗癌症的关键信号通路也可被癌细胞用来抑制免疫系统。他们说,这种增加的理解可作为一种有助于预测哪些患者可能对免疫疗法作出反应的生物标志物。他们还展示了改变这种平衡如何对治疗本身产生潜在影响,这是因为在多种临床前癌症模型中,阻断癌细胞中的这种信号有助于免疫细胞抵抗肿瘤。相关研究结果发表在2019年8月8日的Cell期刊上,论文标题为“Opposing Functions of Interferon Coordinate Adaptive and Innate Immune Responses to Cancer Immune Checkpoint Blockade”。
这项研究重点关注干扰素(IFN)信号通路。干扰素通常有助于激活免疫系统来保护细胞免受病毒入侵,并因此得名,这是因为它们实际上干扰了病毒的传播能力。然而,干扰素也会抑制免疫系统。
论文通讯作者、宾夕法尼亚大学免疫治疗、免疫信号与放射中心主任、放射肿瘤学副教授Andy J. Minn博士说道,“这种自相矛盾的影响已出现在诸如慢性病毒感染之类的其他疾病中,但是我们的研究展示了癌细胞如何利用干扰素的抑制特性干扰癌症免疫疗法。”
9.Science子刊:重大进展!duoCAR-T细胞在确保不被HIV感染的同时高效抑制HIV
doi:10.1126/scitranslmed.aav5685
在一项新的研究中,来自美国生物技术公司Lentigen、阿尔伯特-爱因斯坦医学院、美国国家癌症研究所、阿拉巴马大学伯明翰分校、伯明翰退伍军人医疗中心和匹兹堡大学的研究人员发现他们构建的duoCAR-T细胞在人源化小鼠模型中有效地抵抗HIV。相关研究结果发表在2019年8月7日的Science Translational Medicine期刊上,论文标题为“Multispecific anti-HIV duoCAR-T cells display broad in vitro antiviral activity and potent in vivo elimination of HIV-infected cells in a humanized mouse model”。在这篇论文中,他们描述了如何构建duoCAR-T细胞以及它们如何很好地在人源化小鼠模型中发挥作用。

嵌合抗原受体(CAR)-T细胞(CAR-T)是对从患者体内取出的T细胞进行基因改造而获得新特性后产生的。在最近的一些病例中,它们发生改变的方式促使它们更有效地攻击癌细胞。这种技术涉及添加编码一种受体的基因,所编码的受体结合仅在癌细胞中发现的蛋白。几年前,一组研究人员在HIV感染者中尝试了这种技术。经证实,它在某些情况下是有效的,但是科学家们发现CAR-T细胞本身很容易被这种病毒感染。
在这项新的研究中,这些研究人员采用了一种更新的方法来使用CAR-T细胞来对抗HIV,让它们的CAR分子加倍。由此所获得的细胞被命名为duoCAR-T细胞。他们报道这种新方法的优势在于它靶向HIV包膜上的多个位点,而不是让T细胞发生改变后以CD4受体作为靶向位点。所使用的这两种特定的CAR分子是在开发40多种慢病毒载体并测试它们以观察哪种慢病毒载体是最有效的过程中发现的。
这些研究人员报道,在实验室测试时,他们的duoCAR-T细胞消除了大约99%的受感染的免疫细胞品系。当在人类小鼠模型上进行测试时,duoCAR-T细胞的剂量在治疗仅一周后能够抑制97%的HIV感染---远远优于传统的CAR-T细胞。他们还报道,duoCAR-T细胞经证实对HIV感染有抵抗力,这就克服了传统使用CAR-T细胞治疗HIV患者所面临的一个主要问题。最后,他们报道旨在测试这种新方法的有效性和安全性的临床试验计划最早在明年春天开始。(生物谷 Bioon.com)
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Science子刊:重大进展!新型CAR-T细胞疗法有望克服血癌复发
doi:10.1126/scitranslmed.aaw9414
在一项新的研究中,来自中国四川大学华西医院、郑州大学第一附属医院、大连医科大学附属第二医院、美国希望之城、南加州大学和威尔康乃尔医学院的研究人员报道首个靶向癌细胞上表达的B细胞活化因子受体(B cell activating factor receptor, BAFF-R)的CAR-T细胞根除了动物模型中对CD19靶向疗法产生抵抗性的人白血病细胞和淋巴瘤细胞。这种新疗法将于明年在临床试验中用于治疗对在接受CD19免疫疗法治疗后出现癌症复发的患者,并有可能用作一线的CAR-T细胞免疫疗法。相关研究结果发表在2019年9月25日的Science Translational Medicine期刊上,论文标题为“CAR T cells targeting BAFF-R can overcome CD19 antigen loss in B cell malignancies”。论文通讯作者为希望之城综合癌症中心副主任Larry Kwak博士。论文第一作者为希望之城血液学与造血细胞移植系教授Hong Qin博士。

细胞分裂期间的癌细胞,图片来自NIH。
据估计有20%至30%的在接受CD19 CAR-T细胞治疗后获得病情缓解的白血病患者和淋巴瘤患者将在几年后出现癌症复发。这些靶向癌性B细胞表面上表达的CD19蛋白的CAR-T细胞的功效开始减弱,因此癌症就复发了。
在这项新的研究中,携带CD19治疗抗性的人类肿瘤(包括伯基特淋巴瘤、套细胞淋巴瘤和其他的非霍奇金淋巴瘤亚型,以及急性淋巴细胞白血病)的动物模型接受了BAFF-R CAR-T细胞治疗。在接受这些CAR-T细胞治疗后,他们观察到明显的肿瘤消退和延长的生存期。在携带人类伯基特淋巴瘤的动物模型中,它们在接受单次BAFF-R CAR-T治疗后即可治愈(肿瘤完全消退,长期生存率100%)。在这项研究的另一部分中,动物模型具有CD19阳性人类肿瘤和CD19阴性人类肿瘤的混合群体。然后,它们接受CD19 CAR-T细胞疗法或BAFF-R CAR-T细胞疗法;BAFF-R CAR-T细胞能够根除这两种肿瘤群体,而在接受CD19 CAR-T细胞治疗的动物模型中,这种治疗失败了。
这些研究人员还研究了来自在接受CD19靶向免疫治疗药物博纳吐单抗治疗后出现癌症复发的患者的肿瘤样本。这项研究证实BAFF-R CAR-T细胞始终如一地有效地抵抗这些肿瘤,然而,相比于治疗前的样本,CD19 CAR-T细胞对每个患者复发性肿瘤的反应大大减少。
2.Nat Med:CAR-T细胞疗法处于“免疫治疗革命”的风口浪尖
doi:10.1038/s41591-019-0564-6
在一篇新的综述文章中,美国斯坦福大学医学中心的Robbie Majzner博士和Crystal Mackall博士总结道,对免疫系统在控制癌症中作用的更深入理解有助于推动“免疫治疗革命”,并且为许多患上先前无法治愈的癌症的患者(包括儿童患者)带来了希望。这篇文章发表在2019年9月的Nature Medicine期刊上,文章标题为“Clinical lessons learned from the first leg of the CAR T cell journey”。
CAR-T细胞疗法是一种针对血液癌症的癌症疗法。这种单次灌注治疗依靠患者自身的免疫系统细胞来抵抗癌症。在2000年代初期开展的初步实验室测试以及随后的数百项临床试验表明从免疫系统招募重要的免疫细胞可以以高度个性化的方式抗击癌症。CAR-T细胞疗法涉对T细胞进行基因修饰,仅是越来越多的癌症免疫疗法中的一种,这些疗法表明免疫系统的成分如何可以被有益地利用。
两种CAR-T细胞药物已获得美国食品药物管理局(FDA)的批准:诺华公司的产品Kymriah(通用名tisaglenlecleucel)于2017年8月获得批准,随后在同年10月Yescarta(通用名axicabtageneciloleucel)获得批准。Yescarta由美国吉利德科学公司(Gilead Sciences)旗下子公司Kite制药公司(Kite Pharmaceuticals)开发。Kymriah用于治疗25岁或以下的患有对先前疗法无反应的急性B淋巴细胞性白血病(B-ALL)的患者。Yescata的目标人群是患有对常规治疗无反应的B细胞癌的成年患者。
正如Majzner和Mackall在他们的分析中强调的那样,CAR-T细胞疗法与任何形式的癌症治疗一样极其复杂。一些患者对这种灌注疗法有很强的反应;其他人则会发生癌症复发。Majzner和Mackall认为,某些形式的癌症,特别是实体瘤,对CAR-T细胞疗法的反应不如血液癌症好,但是当前的与CAR-T细胞疗法相关的弊病可能不会持续到将来。
Majzner和Mackall报道,“疾病组织学已成为影响CAR-T细胞治疗结果的主要因素。尽管在实体瘤中CAR-T细胞的治疗结果还不那么强大,但是在人体试验中表现出的临床疗效的一些早期迹象暗示了即将来临的成功。对影响反应和抵抗性的因素的进一步理解正在推动下一代CAR-T细胞疗法的开发,从而有望在血液癌症和实体瘤中实现更高的疗效。”
3.Science子刊:驯服细胞因子怪兽!揭示T细胞激活疗法中毒性细胞因子释放机制
doi:10.1126/scitranslmed.aax8861
经基因改造后结合癌细胞抗原并激活T细胞杀死癌细胞的双特异性抗体显示出临床前景。不幸的是,由于不受控制的免疫激活和细胞因子释放,它们也可能引起严重的毒副作用。无论采用哪种方式,T细胞激活疗法通常都会伴随全身性细胞因子释放,这可能会进展为致命性的细胞因子释放综合征(CRS),即细胞因子风暴。鉴于在机制上对T细胞激活和全身性细胞因子释放之间的关系的不完全理解,人们尚不清楚如何实现保留全部治疗潜力的最佳毒性管理。
在一项新的研究中,来自美国基因泰克公司的研究人员报道了将CD3双特异性抗体介导的杀伤与毒性细胞因子释放相关联在一起的细胞类型特异性的细胞机制。这种免疫级联反应是由T细胞触发引起的,然而单核细胞和巨噬细胞是全身毒性细胞因子释放的主要来源。他们证实T细胞产生的肿瘤坏死因子α(TNF-α)是CD3双特异性抗体治疗后介导单核细胞激活和全身性细胞因子释放的主要机制。相关研究结果发表在2019年9月4日的Science Translational Medicine期刊上,论文标题为“CD3 bispecific antibody–induced cytokine release is dispensable for cytotoxic T cell activity”。

图片来自Science Translational Medicine, 2019, doi:10.1126/scitranslmed.aax8861。
阻止TNF-α释放足以在不影响抗肿瘤效果的同时破坏单核细胞细胞因子的全身性释放。仅在最初暴露于CD3双特异性抗体时才观察到全身性细胞因子释放,而在后续的CD3双特异性抗体剂量暴露中则观察不到,这表明剂量之间存在生物学差异。尽管第二次暴露后细胞因子释放受损,但T细胞的细胞毒性仍然不受影响,这表明在不释放细胞因子的情况下可以实现T细胞的细胞溶解活性。在CD3双特异性抗体存在的情形下,毒性细胞因子与T细胞的细胞溶解活性在机制上的解偶联为临床上探索减轻毒性的预防性治疗方法提供了生物学依据。这项新的研究为在未来通过进一步改进CAR-T细胞免疫疗法降低细胞因子释放综合征同时确保它的抗肿瘤免疫反应不受影响奠定了基础。
4.Science子刊:抑制抗原非依赖性信号转导可降低CAR-T细胞的毒副作用
doi:10.1126/scisignal.aax1872
在一项新的研究中,来自英国和美国的研究人员发现利用时程质谱流式细胞技术(time course mass cytometry)进行的单细胞分析提供了一种快速地评估CAR-T细胞活化的方法。他们发现在CAR-T细胞增殖期间,增加αβ T细胞数量的过程足以增加αβ T细胞中抗原非依赖性信号转导。相反之下,γδT细胞增殖并不改变它们的基础活性。当这些γδT细胞经基因改造后表达嵌合共刺激受体(chimeric costimulatory receptor, CCR)时,它们特异性地识别发生转化的骨髓细胞,但不能识别健康的骨髓细胞。这些数据展示了一种设计特异性抗肿瘤反应的策略,可避免与抗原非依赖性信号转导相关的并发症。相关研究结果发表在2019年9月10日的Science Signaling期刊上,论文标题为“Engineering γδT cells limits tonic signaling associated with chimeric antigen receptors”。
他们比较了发生增殖的T细胞和经转导表达第二代CAR的T细胞中的信号转导,结果发现T细胞增殖增强了对刺激作出的反应。然而,这种细胞增殖也诱导抗原非依赖性信号转导和下降的T细胞信号转导网络可塑性,这与T细胞衰竭(T cell exhaustion)标志物PD-1和TIM-3的表达相关。
鉴于这一点在CD3ζ下游的通路中最为明显,他们对表达缺乏CD3ζ但含有DAP10刺激结构域的嵌合共刺激受体(chimeric costimulatory receptor, CCR)的γδT细胞进行了类似的分析。这些CCR-γδT细胞并未显示出抗原非依赖性信号转导,但是在存在CCR特异性刺激或同源白血病细胞的情况下可被有效激活并产生细胞毒性反应。
单细胞信号分析可以对CAR-T和CCR-T细胞激活进行详细表征,以更好地了解它们的功能活性。此外,他们证实在髓系恶性肿瘤中,CCR-γδT细胞可能具有避免脱靶毒性作用和同种异体反应性的潜力。
5.Nat Med:临床试验表明新型CAR-T细胞疗法有望更安全地治疗急性淋巴细胞白血病
doi:10.1038/s41591-019-0549-5
在一项新的临床研究中,来自英国伦敦大学学院(UCL)的Persis Amrolia教授、Sara Ghorashian博士及其团队开发出一种旨在更快靶向癌细胞并导致更少副作用的新型CAR-T细胞疗法。这种方法在治疗以前无法治愈的急性淋巴细胞白血病(ALL)患儿方面提供非常有前景的结果。相关研究结果发表在2019年9月的Nature Medicine期刊上,论文标题为“Enhanced CAR T cell expansion and prolonged persistence in pediatric patients with ALL treated with a low-affinity CD19 CAR”。 在这项称为CARPALL的临床试验中,他们在患有复发性ALL的儿童和青年人中测试了这种新型的CAR-T细胞疗法。

图片来自Nature Medicine, 2019, doi:10.1038/s41591-019-0549-5。
在CAR T细胞疗法中,称为T细胞的免疫细胞经基因改造后在它们的表面上含有称为嵌合抗原受体(CAR)的分子,因而能够特异性地识别癌细胞。比如,在这种方法中,患者自身的T细胞经过基因改造后含有一种称为CAT-19的新型CAR分子,这种新型CAR分子是由UCL癌症研究所的Martin Pule博士实验室开发的。
这些经过基因改造的CAR-T细胞用于治疗大欧蒙街儿童医院(GOSH)、曼彻斯特儿童医院和伦敦大学医院的14例复发性ALL患者。这些研究人员发现在接受这种CAR-T细胞治疗后,其中的12名患有无法治愈ALL的患者在3个月后清除了他们所患的疾病并且5名患者仍然保持无白血病状态。患者也经历了更少的称为细胞因子释放综合征(CRS)的有害副作用。
6.Nature:重大进展!除了治疗癌症之外,CAR-T细胞还有望用于治疗心脏病
doi:10.1038/s41586-019-1546-z
CAR-T细胞疗法是一种快速出现的免疫疗法,使用患者自身的T细胞来治疗某些类型的癌症。它也可能是另一种危及生命的疾病---心脏病---的可行治疗选择。在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员使用经过基因修饰的T细胞来靶向和移除促进心肌纤维化(cardiac fibrosis)---一种在大多数心脏病类型中发现的导致心脏僵硬和心脏功能下降的瘢痕形成过程---产生的活化成纤维细胞(activated fibroblast)。他们发现在由高血压引起心脏病的小鼠中,这种细胞疗法显著降低心肌纤维化并恢复心脏功能。相关研究结果于2019年9月11日在线发表在Nature期刊上,论文标题为“Targeting cardiac fibrosis with engineered T cells”。
论文通讯作者、宾夕法尼亚大学佩雷尔曼医学院执行副院长Jonathan A. Epstein博士说,“利用患者自身的细胞来对抗癌症的能力一直是过去十年最有前景的研究突破之一,我们很高兴能找到利用这种相同的技术治疗其他常见疾病的方法。虽然在我们将这种方法引入临床环境之前还需开展更多的研究,但是这标志着我们在治疗---潜在地逆转---一种加快心力衰竭进展的病症的研究工作中迈出重要一步。”
7.研究开发超级免疫细胞!
新闻来源:Super-powered immune cells
一项一期临床试验将测试的CAR-T细胞可行性和安全性,这是一种修改从病人自身的血液获得的T细胞使之具有独特的能力来直接攻击和杀死癌细胞的先进的癌症治疗策略癌症,包括小细胞肺癌肉瘤和三阴性乳腺癌。新的临床试验将使研究人员更多地了解CAR-T细胞如何与实体肿瘤相互作用,希望这种基于免疫的疗法有一天能治疗多种不同的癌症。这项试验由南澳大利亚大学癌症生物研究中心(center for Cancer biologology)领导,该中心是南澳大利亚大学(University of South Australia)、阿德莱德中央地方卫生网络(CALHN)和阿德莱德皇家医院(Royal Adelaide Hospital)的联盟。
负责制造CAR-T细胞产品并跟踪患者治疗反应的研究科学家是南澳大利亚大学的Tessa Gargett博士,她是癌症生物学中心的研究员。她说CAR-T免疫疗法显示出发展癌症治疗的巨大潜力。
"嵌合抗原受体(CAR) T细胞是癌症免疫治疗领域一项很有前途的新技术。从本质上讲,CAR-T细胞是一种超强的免疫细胞,它的工作原理是招募并增强患者免疫系统攻击肿瘤的能力。他们在治疗某些形式的化疗耐药血癌方面取得了令人震惊的结果,但在治疗实体癌症方面还没有取得类似的突破--这就是这项研究的切入点。"Gargett博士说。
8.Cell:操纵干扰素信号有望让癌症免疫疗法变得有效
doi:10.1016/j.cell.2019.07.019
在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现一种能够告诉免疫系统抵抗癌症的关键信号通路也可被癌细胞用来抑制免疫系统。他们说,这种增加的理解可作为一种有助于预测哪些患者可能对免疫疗法作出反应的生物标志物。他们还展示了改变这种平衡如何对治疗本身产生潜在影响,这是因为在多种临床前癌症模型中,阻断癌细胞中的这种信号有助于免疫细胞抵抗肿瘤。相关研究结果发表在2019年8月8日的Cell期刊上,论文标题为“Opposing Functions of Interferon Coordinate Adaptive and Innate Immune Responses to Cancer Immune Checkpoint Blockade”。
这项研究重点关注干扰素(IFN)信号通路。干扰素通常有助于激活免疫系统来保护细胞免受病毒入侵,并因此得名,这是因为它们实际上干扰了病毒的传播能力。然而,干扰素也会抑制免疫系统。
论文通讯作者、宾夕法尼亚大学免疫治疗、免疫信号与放射中心主任、放射肿瘤学副教授Andy J. Minn博士说道,“这种自相矛盾的影响已出现在诸如慢性病毒感染之类的其他疾病中,但是我们的研究展示了癌细胞如何利用干扰素的抑制特性干扰癌症免疫疗法。”
9.Science子刊:重大进展!duoCAR-T细胞在确保不被HIV感染的同时高效抑制HIV
doi:10.1126/scitranslmed.aav5685
在一项新的研究中,来自美国生物技术公司Lentigen、阿尔伯特-爱因斯坦医学院、美国国家癌症研究所、阿拉巴马大学伯明翰分校、伯明翰退伍军人医疗中心和匹兹堡大学的研究人员发现他们构建的duoCAR-T细胞在人源化小鼠模型中有效地抵抗HIV。相关研究结果发表在2019年8月7日的Science Translational Medicine期刊上,论文标题为“Multispecific anti-HIV duoCAR-T cells display broad in vitro antiviral activity and potent in vivo elimination of HIV-infected cells in a humanized mouse model”。在这篇论文中,他们描述了如何构建duoCAR-T细胞以及它们如何很好地在人源化小鼠模型中发挥作用。

关于受HIV感染的T细胞的扫描电镜图,图片来自NIAID。
嵌合抗原受体(CAR)-T细胞(CAR-T)是对从患者体内取出的T细胞进行基因改造而获得新特性后产生的。在最近的一些病例中,它们发生改变的方式促使它们更有效地攻击癌细胞。这种技术涉及添加编码一种受体的基因,所编码的受体结合仅在癌细胞中发现的蛋白。几年前,一组研究人员在HIV感染者中尝试了这种技术。经证实,它在某些情况下是有效的,但是科学家们发现CAR-T细胞本身很容易被这种病毒感染。
在这项新的研究中,这些研究人员采用了一种更新的方法来使用CAR-T细胞来对抗HIV,让它们的CAR分子加倍。由此所获得的细胞被命名为duoCAR-T细胞。他们报道这种新方法的优势在于它靶向HIV包膜上的多个位点,而不是让T细胞发生改变后以CD4受体作为靶向位点。所使用的这两种特定的CAR分子是在开发40多种慢病毒载体并测试它们以观察哪种慢病毒载体是最有效的过程中发现的。
这些研究人员报道,在实验室测试时,他们的duoCAR-T细胞消除了大约99%的受感染的免疫细胞品系。当在人类小鼠模型上进行测试时,duoCAR-T细胞的剂量在治疗仅一周后能够抑制97%的HIV感染---远远优于传统的CAR-T细胞。他们还报道,duoCAR-T细胞经证实对HIV感染有抵抗力,这就克服了传统使用CAR-T细胞治疗HIV患者所面临的一个主要问题。最后,他们报道旨在测试这种新方法的有效性和安全性的临床试验计划最早在明年春天开始。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


