揭示胚胎发育过程中组织水平下的调控机制
来源:本站原创 2019-08-23 09:05
2019年8月23日 讯 /生物谷BIOON/ --在胚胎发育过程中,其会产生正确的3D体型(称之为形态发生过程),同时还需要进行组织重塑,细胞片会折叠并改变其几何形状,其经历的变化相当于折纸的复杂性;在早期胚胎中,形成肌肉组织(中胚层)和肠道组织(内胚层)的细胞会向内运动,外层的细胞会形成皮肤组织,日前,一项刊登在国际杂志Nature上的研究报告中,研究者Bailles等人报道了细胞内化的新型分
2019年8月23日 讯 /生物谷BIOON/ --在胚胎发育过程中,其会产生正确的3D体型(称之为形态发生过程),同时还需要进行组织重塑,细胞片会折叠并改变其几何形状,其经历的变化相当于折纸的复杂性;在早期胚胎中,形成肌肉组织(中胚层)和肠道组织(内胚层)的细胞会向内运动,外层的细胞会形成皮肤组织,日前,一项刊登在国际杂志Nature上的研究报告中,研究者Bailles等人报道了细胞内化的新型分子机制,其正如研究人员对黑腹果蝇(Drosophila melanogaster)研究所得到的结果。
如今研究人员对黑腹果蝇中胚层内化的研究已经建立了细胞特性与细胞发育期间所发生的物理变化之间的分子关联,蛋白质Twist能够调节基因表达从而赋予肌肉的身份,而表达该蛋白的细胞则在保持与邻近细胞接触的同时,收缩其外表面(顶端),这种顶端收缩所引发的组织屈曲会驱动细胞的内化作用,因此,内化在中胚层中是固定的,但其也会产生一定的驱动力,从而影响附近非中胚层的细胞。中胚层的内化与其它细胞内化在发育过程中是否相同呢?尤其是当许多形态发生事件同时发生时,为此研究人员Bailles及其同事回答了这一问题。
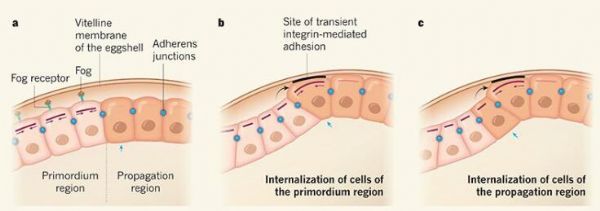
内胚层细胞会内化形成整个内胚层组织(约15行细胞的圆形斑块),从而向早期胚胎的头部区域移动,利用活细胞成像显微镜技术及数学模型所支持的实验性手段,研究者发现,内胚层中有两个不同的区域,其内化机制是并不相同的。研究者称之为原基区域的内胚层部分是第一个发生内化的,其就像中胚层内化一样,这是通过一个直接被基因表达所调节的过程来发生的。蛋白质Fog的表达会导致细胞顶端区域非肌球蛋白(MyoII)和RhoI蛋白水平增加,从而通过重构细胞骨架来引起细胞顶端发生收缩,研究者观察到,局部的Fog活性会导致原基区域所有细胞同时收缩和内化。
图片来源:Bailles et al.
在内胚层的另一部分—传播区(propagation region),内化则是逐步发生的,其会一次形成一排细胞;研究者意外地发现,如果转录被抑制或Fog蛋白的局部来源丢失的话,当原基区域开始收缩时,传播区的内化仍然会发生,将传播区的内化速率与Fog扩散的最大估计速率对比后,就能够帮助研究者排除Fog扩散作为解释如何控制内化过程了。
随后研究者分析了是否机械影响会发挥作用,他们利用物理方法来阻碍组织运动,利用基因方法来改变胚胎几何形态或利用药物来抑制MyoII,研究结果表明,传播区的内化是通过一种机械正反馈系统来进行的,外部物理压力所引发的轻度细胞变形会通过经历内化的邻居细胞来传递,其会诱发非内化细胞的顶端区域中MyoII的积累,这种积累会驱动细胞性状的改变,进而增加机体压力,并促进MyoII积累,直至细胞收缩达到引起细胞内化的水平,邻近细胞之间的机械耦合会通过连接细胞的粘着连接蛋白复合体所介导,从而才能够确保驱动力在整个组织中传递,进而推动传播区逐渐发生内化。
如今研究人员在其它实验系统中已经描述了胚胎发育的机械调节机制,然而,研究人员仍然很难证明是否作用在细胞上的机械力是发育过程中的原因或是结果,尽管研究人员很难评估体内的机械输入,但他们对整个胚胎进行研究或许就能够证明,机械力就是发育最直接的调节子。内胚层区域的细胞在内化发生前都具有内胚层身份的分子特征,尽管有这样的相似性,为何这些区域会使用独特的内化机制呢?这或许是因为,如果整个内胚层同时收缩的话,胚胎的几何形状就会受损,另一种可能性则是,这些区域之间机械敏感性的差异会为应对外部事件的力量提供缓冲。
机械调控在传播区的内化过程中扮演着非常关键的角色,这或许能进一步阐明其在局部基因表达中的作用。研究人员分析了果蝇的卵黄膜是否会影响传播区的内化作用,胚胎和卵黄膜之间的相互作用会提供一种机械力的来源;研究者表示,动态粘附在形态发生的不同状况下发挥着至关重要的作用,而如今研究人员已经证实了整合素介导的卵黄膜粘附的具体分子机制。
未来研究人员还需要进行更为深入的研究来改善他们在分子和细胞水平下对形态发生分子机制的理解,这或许能帮助揭示机械调控和基因调控之间相互作用发生的机制,相关研究结果或许也能够提供控制不同组织和物种中胚胎形态因素的完整画面。(生物谷Bioon.com)
参考资料:
【1】Anais Bailles, Claudio Collinet, Jean-Marc Philippe,Genetic induction and mechanochemical propagation of a morphogenetic wave,Nature,volume 572, pages467–473 (2019) doi:10.1038/s41586-019-1492-9
【2】Gilmour D, Rembold M, Leptin M. From morphogen to morphogenesis and back. Nature. 2017 Jan 18;541(7637):311-320. doi: 10.1038/nature21348.
【3】Butler LC, Blanchard GB, Kabla AJ, et al. Cell shape changes indicate a role for extrinsic tensile forces in Drosophila germ-band extension. Nat Cell Biol. 2009 Jul;11(7):859-64. doi: 10.1038/ncb1894. Epub 2009 Jun 7.
【4】Dawes-Hoang RE, Parmar KM, Christiansen AE, et al. folded gastrulation, cell shape change and the control of myosin localization. Development. 2005 Sep;132(18):4165-78.
【5】Münster S, Jain A1, Mietke A, Pavlopoulos A, et al. Attachment of the blastoderm to the vitelline envelope affects gastrulation of insects. Nature. 2019 Apr;568(7752):395-399. doi: 10.1038/s41586-019-1044-3
【6】Mechanical design in embryos: mechanical signalling, robustness and developmental defects
【7】Morrissey MA, Keeley DP, Hagedorn EJ, et al. B-LINK: a hemicentin, plakin, and integrin-dependent adhesion system that links tissues by connecting adjacent basement membranes. Dev Cell. 2014 Nov 10;31(3):319-331. doi: 10.1016/j.devcel.2014.08.024
【8】Hilbrant M, Horn T, Koelzer S, et al. The beetle amnion and serosa functionally interact as apposed epithelia. Elife. 2016 Jan 29;5. pii: e13834. doi: 10.7554/eLife.13834.
【9】Kristen A. Panfilio. Genetics and mechanics combine to guide the embryonic gut, Nature 572, 446-447 (2019) doi: 10.1038/d41586-019-02398-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。