2019年7月HIV研究亮点进展
来源:本站原创 2019-07-31 21:01
2019年7月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导
2019年7月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的7月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Science子刊:一种新型CMV减毒活疫苗有望长期有效地抵抗HIV攻击
doi:10.1126/scitranslmed.aaw2607
基于巨细胞病毒(CMV)的疫苗载体具有较强的T细胞诱导和抵抗多种病原体的作用。然而,CMV对免疫缺陷或免疫抑制的人群是有害的。之前的研究已证实表达猴免疫缺陷病毒(SIV)蛋白的恒河猴巨细胞病毒(RhCMV)毒株68-1衍生性病毒载体(下称68-1 RhCMV/SIV)能够引发和维持细胞免疫反应,从而让恒河猴免受高度致病性SIV的粘膜攻击。然而,这些有效的68-1 RhCMV/SIV病毒载体具有复制和传播能力,因此有潜力在免疫受损的受试者中引起疾病。
为了开发一种更安全的基于CMV的临床用疫苗,在一项新的研究中,来自美国俄勒冈健康与科学大学、弗雷德里克国家癌症研究实验室和弗雷德-哈钦森癌症研究中心的研究人员通过剔除编码被膜蛋白pp71的Rh110基因(ΔRh110),减弱了68-1 RhCMV/SIV病毒载体的毒力,从而允许抑制裂解基因表达。相关研究结果发表在2019年7月17日的Science Translational Medicine期刊上,论文标题为“A live-attenuated RhCMV/SIV vaccine shows long-term efficacy against heterologous SIV challenge”。
相比于毒力未削弱的68-1 RhCMV/SIV病毒载体,ΔRh110 68-1 RhCMV/SIV病毒载体在体内存在高度传播缺陷(即不能够在体内高效传播),传播能力下降了大约1000倍,但是它们仍然能够重复感染(superinfect)RhCMV阳性恒河猴,并且高频率地产生效应-记忆偏向性的T细胞反应。
这些研究人员证实表达同源或异源SIV抗原的ΔRh110 68-1 RhCMV/SIV病毒载体高度有效地抵抗阴道内SIVmac239病毒(SIV的一种高度致病性的毒株,是一种类似于HIV病毒的非人灵长类动物逆转录病毒)攻击:在59%的接受疫苗(指的是ΔRh110 68-1 RhCMV/SIV病毒载体)接种的恒河猴中,它控制着SIV感染并且渐进性清除SIV。此外,在12只接受疫苗接种后控制着初始SIV攻击并且渐进性清除SIV的恒河猴中,9只恒河猴能够在最后一次疫苗接种大约3年后严格地控制第二次SIV攻击,这证实了这种疫苗的持久性。
2.Science子刊:细胞入侵抑制剂eCD4-Ig有望抵抗高剂量的HIV病毒攻击
doi:10.1126/scitranslmed.aau5409
许多猿猴免疫缺陷病毒(SIV)和猿猴-人类免疫缺陷病毒(SHIV)已被用于评估HIV-1疫苗策略的功效,其中,SIVmac239被认为是最严格的,这是因为与SHIV模型不同的是,它的全基因组在它的恒河猴宿主中经历共同进化,而且它的3级包膜糖蛋白(tier 3 envelope glycoprotein)极难中和。
在一项新的研究中,美国研究人员研究了一种模拟HIV-1和SIV受体和辅助受体的抗体样细胞入侵抑制剂---eCD4-Ig---阻止SIVmac239感染的能力。eCD4-Ig是一种经过修饰的CD4蛋白。相关研究结果发表在2019年7月24日的期刊上,论文标题为“AAV-delivered eCD4-Ig protects rhesus macaques from high-dose SIVmac239 challenges”。
这些研究人员发现由重组腺相关病毒(AAV)载体表达的rh-eCD4-IgI39N让4只恒河猴完全免受高剂量SIVmac239攻击,相比之下,8只对照恒河猴在相同情形下全部受到感染。然而,表达rh-eCD4-IgI39N的恒河猴最终死于一系列升高的SIVmac239攻击剂量,这一系列升高的攻击剂量分别是感染对照恒河猴的攻击剂量的2倍、8倍、16倍和32倍。尽管接受了更大的攻击剂量,这些rh-eCD4-IgI39N恒河猴的病毒载量峰值和峰值后病毒载量显著低于对照恒河猴。有证据表明从这4只表达rh-eCD4-IgI39N的恒河猴中的3只体内分离出的SIV病毒经历较强的来自rh-eCD4-IgI39N的选择性免疫压力。相比于恒河猴CD4,rh-eCD4-IgI39N发生了点突变。为了逃避这种细胞入侵抑制剂的作用,这些分离出的SIV病毒也发生了突变,所发生的突变位于CD4结合位点。在一只表达rh-eCD4-IgI39N的恒河猴中,它们发生的突变利用了rh-eCD4-IgI39N和恒河猴CD4之间的点突变差异逃避这种细胞入侵抑制剂的作用。其他的逃避途径与这种病毒的适应成本(fitness cost)相关。
3.突破!Science子刊报道新型减毒HIV疫苗,安全无毒疗效佳!
doi:10.1126/scitranslmed.aaw2603
一种有望从猴子身上清除艾滋病病毒的疫苗距离人体试验又更近了一步,因为一种新的弱疫苗已被证明可以提供与原疫苗类似的保护。近日发表在《Science Translational Medicine》杂志上的两篇论文描述了这种疫苗--它使用了一种常见的巨细胞疱疹病毒(cytomegalovirus,简称CMV)--是如何被活减毒或削弱的,以便CMV不会轻易传播。这种新的疫苗成功地消灭了59%的接种过疫苗的恒河猴体内的猴免疫缺陷病毒,即猴子版的HIV。这一结果与早期关于原始非减毒疫苗的结果相似。减毒疫苗产生的免疫力也很持久,因为接种疫苗的12只猴子中有9只在3年后仍能抵抗SIV感染。

疫苗毒性减弱是应用于人类的关键。出于安全考虑,没有疫苗使用非减毒活病毒。虽然人类感染巨细胞病毒后通常没有任何问题,但这种病毒可以对免疫系统薄弱的人造成严重破坏,比如器官移植患者。这对孕妇也是危险的,因为它会导致先天缺陷,如婴儿听力损失和小头畸形。
论文共同通讯作者Klaus fruh博士说:"这项使用恒河猴巨细胞病毒的研究为设计基于人类巨细胞病毒的HIV疫苗提供了潜在的重要理论。我们显着降低了巨细胞病毒毒性,并且仍然得到了与野生版本的这种疫苗相同的免疫反应。"
论文共同通讯作者医学博士Louis Picker说:"这些论文很重要,因为它们总结了之前报道过的独特的CMV载体的功效,该载体具有高度衰减的基因修饰,因此在临床使用中具有潜在的安全性。"此外,新研究还表明,大多数接种过疫苗的恒河猴在首次接种SIV疫苗数年后,也可以免受第二次感染。
4.PLoS Pathog:揭示HIV感染如何导致心脏病、糖尿病和痴呆症等一系列慢性疾病
doi:10.1371/journal.ppat.1007907
在一项新的研究中,来自澳大利亚贝克心脏与糖尿病研究所的研究人员发现由HIV感染的细胞释放出的单个病毒因子可能对身体造成严重破坏,并导致心脏病、糖尿病和痴呆症等慢性的潜在致命性的疾病的产生。这一发现潜在地促进人们开发可能有助于为全球3600万HIV感染者提供更长更健康的生活的靶向疗法。相关研究结果于2019年7月25日的PLoS Pathogens期刊上,论文标题为“Exosomes containing HIV protein Nef reorganize lipid rafts potentiating inflammatory response in bystander cells”。
对HIV/AIDS的治疗是如此先进,以至于HIV感染者的预期寿命与未感染者的预期寿命非常相似。然而,HIV感染者可能会出现心脏病、糖尿病、痴呆症或相关并发症等合并并发症(co-morbidities)。已有研究表明,HIV感染者不仅患这些慢性疾病的风险增加,而且发病年龄较小,疾病进展较快。
这些研究人员发现来自受到HIV感染的细胞的HIV蛋白---Nef---以外泌体(一种特定的胞外囊泡)的形式释放出来,并被未感染的“旁观者”细胞摄取,从而破坏这些细胞中的胆固醇代谢。这种胆固醇代谢受损引发炎症,从而促进痴呆症、心脏病和糖尿病等疾病的产生。
5.Cell Rep:一种新型疫苗阻止HIV感染有戏!
doi:10.1016/j.celrep.2019.06.074
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员开发出一种由DNA和重组蛋白组成的新型疫苗,其中重组蛋白由一种HIV蛋白的一部分和另一种不相关的蛋白组成。这种疫苗在猴子身上进行了测试,测试结果表明它能够诱导出的抗体类似于与抵抗HIV感染相关的抗体。相关研究结果发表在2019年7月23日的Cell Reports期刊上,论文标题为“Multimeric Epitope-Scaffold HIV Vaccines Target V1V2 and Differentially Tune Polyfunctional Antibody Responses”。

这些研究人员首先鉴定出HIV病毒的一部分,当与抗体结合时,会导致这种病毒和受到它感染的细胞遭受破坏。他们随后设计出一种可诱导这些类型抗体产生的疫苗。这种疫苗设计方法称为“反向疫苗学(reverse vaccinology,也译作逆向疫苗学)”。
这些研究人员鉴定出的HIV病毒靶标称为gp120包膜蛋白上的V1V2环。在针对接受用gp120 DNA和三种携带这种V1V2区域的新型重组蛋白接种的猴子开展的实验中,这种疫苗接种诱导出显示许多不同抗病毒功能的抗体。这些抗体属于在之前的人类临床试验中与HIV感染率下降相关的抗体类型。
6.Nat Immunol:揭示CCR5AS lncRNA多态性影响HIV感染
doi:10.1038/s41590-019-0406-1
在一项新的研究中,美国德州生物医学研究所助理教授Smita Kulkarni博士和美国弗雷德里克国家癌症研究实验室的Mary Carrington博士领导的一个研究团队确定了一种长链非编码RNA(lncRNA)影响一种参与HIV感染和疾病进展的关键受体。这种新鉴定出的机制可能为控制HIV感染开辟了一条新的途径。相关研究结果发表在2019年7月的Nature Immunology期刊上,论文标题为“CCR5AS lncRNA variation differentially regulates CCR5, influencing HIV disease outcome”。
Kulkarni和她的同事们发现一种称为CCR5AS的特定lncRNA影响编码HIV辅助受体CCR5的基因。鉴于CCR5对于HIV病毒侵入细胞至关重要,因此与这种lncRNA的表达变化相关联的多态性会影响HIV感染的结果。来自西班牙裔美国人、非洲裔美国人和日本人等各种群体的基因组DNA表明这种关联性存在于许多种族中。这种关联性在不同人群中的一致性表明存在一种解释这种关联性的单个功能性机制。
7.Nat Immunol:尽管接受ART治疗,大多数HIV感染者的免疫系统仍存在无法修复的漏洞
doi:10.1038/s41590-019-0418-x
2017年,将近3700万人感染上HIV病毒。每天,世界各地的卫生当局报道了5000例新的HIV感染病例。如果不接受抗逆转录病毒疗法(ART),那么大多数HIV患者的免疫系统就会经历渐进性削弱。但是,仅很小比例的患者---0.3%---在不接受ART治疗的情形下自行地控制这种病毒。对这种现象作出的解释部分在于识别HIV的稀有白细胞表达的一组基因吗?在一项新的研究中,来自加拿大蒙特利尔大学医院研究中心的研究人员给出了肯定的答案。相关研究结果于2019年7月15日在线发表在Nature Immunology期刊上,论文标题为“Altered differentiation is central to HIV-specific CD4+ T cell dysfunction in progressive disease”。

CD4 T细胞在协调免疫反应中起着关键作用,是有助于控制HIV病毒等慢性感染的重要白细胞。但是,平均而言,CD4 T细胞群中仅有大约1000个细胞能够识别这种病毒。
论文通讯作者、加拿大蒙特利尔大学医院研究中心研究员、传染病专家Daniel Kaufmann说道,“在我的研究团队和合作者的帮助下,我们全面确定了来自长期感染上HIV的患者的血液的这些罕见细胞表达的全部基因,在这些患者中,在接受ART治疗之前,这种病毒在血液中大量存在。我们随后将这些细胞与来自HIV控制者(HIV controller)---在未接受治疗的情形下,能够控制这种病毒的患者---的细胞进行比较。这种强大的方法,也称为全基因组转录分析,一次测量数千个基因的活性,因而可构建出全局的细胞功能图谱。”
通过使用复杂的细胞分析技术,论文第一作者、Kaufmann实验室博士后研究员Antigoni Morou鉴定出这两组患者之间的主要功能差异。比如,HIV控制者具有更强大的Th17和Th22免疫反应,这对于胃肠道的防御是重要的。但是在具有高水平HIV病毒复制的慢性感染患者中,靶向HIV的CD4 T细胞出现功能失调,而且他们的一些细胞亚群显示出异常功能的迹象。
8.JCI:长期接受抗逆转录病毒治疗的个体中,感染艾滋病毒的细胞持续存在脑脊液中
doi:10.1172/JCI127413
7月15日发表在《Journal of Clinical Investigation》上的一项研究显示,在接受长期抗逆转录病毒治疗(ART)的艾滋病毒阳性患者中,约有一半的人的脑脊液中含有艾滋病毒感染细胞。
医学博士Serena Spudich及其耶鲁大学的同事们研究了HIV在脑脊液中的持久性,以及在长期接受ART治疗期间炎症和神经认知表现的关系。69名参与艾滋病临床试验组HIV携带者队列研究的参与者同时接受了腰椎穿刺、静脉切开术和神经认知评估。在外周血单核细胞和脑脊液细胞微球中检测细胞相关(CA) HIV DNA和RNA,在脑脊液上清液和血浆中检测无细胞HIV RNA。
参与者在接受平均8.6年的ART治疗后接受评估。研究人员发现,在4%、9%和48%的参与者的脑脊液中分别检测到无细胞RNA、CA-RNA和CA-DNA。无细胞脑脊液HIV RNA检测与血浆HIV RNA检测存在相关性。脑脊液炎症标志物与HIV持续性检测结果无相关性。即使在调整了年龄和CD4最低点计数之后,研究人员仍然发现CSF CA-DNA检测与更糟的神经认知结果(包括全球缺陷评分)之间存在相关性。
9.Nat Metabol:研究揭示CD8抵抗HIV感染的机制,成功重编程CD8细胞清除HIV
doi.org/10.1038/s42255-019-0081-4
近15年来,天然抵抗艾滋病毒感染的罕见个体的细胞一直是研究的重点,目的是阐明它们的具体特征。在对ANRS CO21 CODEX和CO6 PRIMO的研究之后,巴斯德研究所的科学家描述了这些"HIV控制器"研究对象中CD8免疫细胞的特征。这些免疫细胞独特的抗病毒能力可以归因于一个最佳的代谢程序,它提供了持久性和对感染细胞作出有效反应的能力。在体外工作时,科学家们成功地对受感染的非控制者的细胞进行了重新编程,使它们具有与控制者细胞相同的抗病毒能力。他们的研究结果于近日发表在《Nature Metabolism》杂志上。
有些人无需治疗就能自然控制艾滋病毒。在这些非常罕见的个体中(不到1%的艾滋病毒感染者),在未经治疗的情况下,在感染超过10年后血液中仍然无法检测到病毒的增殖。2007年,巴斯德研究所的科学家描述了这些患者CD8淋巴细胞的抗病毒活性。与非控制者不同,HIV控制者的CD8细胞能够迅速摧毁受感染的CD4细胞。
可以控制HIV的患者的CD8细胞(或"记忆细胞")表面上看起来与不可控制HIV的患者的相同。但是科学家们证明了他们有一个不同的分子程序。他们的研究表明,控制者体内的抗HIV CD8细胞不仅具有巨大的抗病毒潜力;它们也被编程以持续生存,而在非控制者体内,细胞程序使它们易于衰竭和细胞死亡。
10.Science子刊:揭示抗逆转录病毒药物在三种物种肠道中的不均匀分布
doi:10.1126/scitranslmed.aap8758
携带残留HIV病毒的组织(包括肠道)未能充分地暴露于抗逆转录病毒药物(ART)中可能导致HIV的持久存在。这可能导致组织中的HIV病毒复制增加。测量组织中药物浓度的传统方法无法表征药物的不均匀分布。
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校、俄勒冈健康与科学大学、科罗拉多州立大学、加州大学戴维斯分校、北卡罗莱纳州立大学和弗雷德里克国家癌症研究实验室的研究人员利用质谱成像(mass spectrometry imaging, MSI)技术可视化观察6种ART药物在来自三种物种(两种人源化小鼠品系、恒河猴和人类)的肠道组织切片中的分布。相关研究结果发表在2019年7月3日的Science Translational Medicine期刊上,论文标题为“Heterogeneous antiretroviral drug distribution and HIV/SHIV detection in the gut of three species”。
这些研究人员测量了HIV靶向的CD3+ T细胞附近的药物浓度,以及在来自HIV感染的人源化小鼠、SHIV感染的恒河猴和HIV感染的人类患者在接受ART药物联合治疗后的肠道组织中的HIV或SHIV RNA表达和MDR1药物外排转运蛋白的表达。他们利用质谱成像技术可视化观察速冻的回肠和直肠组织的连续10μm切片,并且通过免疫荧光和免疫组织化学分别分析这些组织切片中的CD3+ T细胞和MDR1药物外排转运蛋白表达。他们利用原位杂交分析方法分析了这些组织切片中的HIV/SHIV RNA表达,并且利用液相色谱-质谱联用技术测量了ART药物浓度。基于这些测量结果,他们发现这六种ART药物在胃肠道组织中的分布是不均匀的。50%~60%的CD3+ T细胞未能与肠道组织中可检测到的药物浓度共存。
这些研究人员发现在这三种物种中,在ART药物治疗期间,仍然能够检测到HIV/SHIV RNA,特别是在ART药物浓度较低的组织区域,这可能导致低水平的HIV/SHIV病毒复制。特别地,他们发现高达90%的HIV/SHIV RNA在没有接触ART药物的肠道组织中表达。
11.JAHA:HIV感染增加心力衰竭和中风风险
doi:10.1161/JAHA.119.012241
在一项新的研究中,来自美国埃默里大学和乔治亚州立大学的研究人员在对来自一个大型健康保险数据库的信息进行分析后,发现HIV患者患上心血管疾病(CVD)---特别是心力衰竭和中风---的风险较高。这一发现表明需要加大力度保护这些患者的心血管健康。相关研究结果发表在2019年7月16日的Journal of the American Heart Association期刊上,论文标题为“HIV Infection and Incidence of Cardiovascular Diseases: An Analysis of a Large Healthcare Database”。
在这项研究中,这些研究人员分析了19798名HIV感染者以及59302名年龄和性别匹配的未感染者的信息,并且对这些人平均随访20个月。HIV感染者患心力衰竭和中风的风险分别高出3.2倍和2.7倍。
HIV感染与心血管疾病之间的关联性对于年龄小于50岁的人和没有心血管疾病史的人尤为强烈。HIV感染者患外周动脉疾病的风险并未增加,而且他们的心脏病发作或心房颤动的风险也只有中度增加。
12.Nat Commun:HIV研究新发现!CD11c+树突细胞或是机体HIV感染的一线免疫细胞
doi:10.1038/s41467-019-10697-w
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自西米德医学研究所(Westmead Institute for Medical Research)的科学家们通过研究发现,全新的免疫细胞或许处于HIV感染的前线,这些名为CD11c+的树突细胞对于HIV的感染非常易感,而且能将病毒传染给其它细胞。
CD11c+ 树突细胞是一类树突细胞(一类免疫细胞),其仅存在于人类的生殖器组织中,尤其是阴道、内包皮和肛门的上皮组织中(形成表面的组织薄层),在生殖器组织中的定位意味着,这些新发现的CD11c+ 树突细胞或许就是与HIV相互作用的第一批免疫细胞。研究者Andrew Harman教授表示,CD11c+ 树突细胞所扮演的角色就是捕获任何进入机体的病原体,随后再将病原体传递给CD4 T细胞。CD4 T细胞主要负责驱动机体对病原体的免疫反应,更有意思的是,其也是病毒进行复制的主要HIV靶向性细胞。
一旦树突细胞捕获病原体,其就会与淋巴结中的CD4 T细胞相互沟通,并让机体免疫系统不断更新,这些信息就会使得免疫系统做好准备,要么对细菌或病毒耐受,要么对其发起攻击。然而,如果CD4 T细胞的水平降低到临界水平以下,机体就无法产生足够的免疫反应来抵御HIV了。
如今研究人员发现,相比其它已知的树突细胞而言,CD11c+ 树突细胞对于HIV感染的易感性较强,而且CD11c+ 树突细胞与CD4 T细胞相互作用要比其它树突细胞更为有效;更重要的是,CD11c+ 树突细胞能将病毒传递给CD4 T细胞,使其成为HIV感染的关键驱动器,由于这些树突细胞能与CD4 T细胞发生有效的相互作用,因此其就能够成为开发疫苗的重要候选细胞。(生物谷 Bioon.com)
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的7月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Science子刊:一种新型CMV减毒活疫苗有望长期有效地抵抗HIV攻击
doi:10.1126/scitranslmed.aaw2607
基于巨细胞病毒(CMV)的疫苗载体具有较强的T细胞诱导和抵抗多种病原体的作用。然而,CMV对免疫缺陷或免疫抑制的人群是有害的。之前的研究已证实表达猴免疫缺陷病毒(SIV)蛋白的恒河猴巨细胞病毒(RhCMV)毒株68-1衍生性病毒载体(下称68-1 RhCMV/SIV)能够引发和维持细胞免疫反应,从而让恒河猴免受高度致病性SIV的粘膜攻击。然而,这些有效的68-1 RhCMV/SIV病毒载体具有复制和传播能力,因此有潜力在免疫受损的受试者中引起疾病。

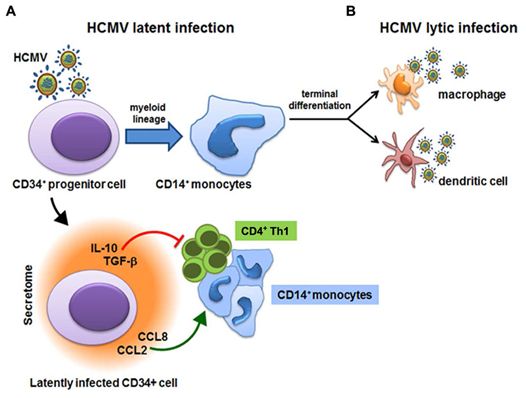
HCMV的分泌蛋白质组和潜伏,图片来自Frontiers in Microbiology, 2016, doi:10.3389/fmicb.2016.00715。
为了开发一种更安全的基于CMV的临床用疫苗,在一项新的研究中,来自美国俄勒冈健康与科学大学、弗雷德里克国家癌症研究实验室和弗雷德-哈钦森癌症研究中心的研究人员通过剔除编码被膜蛋白pp71的Rh110基因(ΔRh110),减弱了68-1 RhCMV/SIV病毒载体的毒力,从而允许抑制裂解基因表达。相关研究结果发表在2019年7月17日的Science Translational Medicine期刊上,论文标题为“A live-attenuated RhCMV/SIV vaccine shows long-term efficacy against heterologous SIV challenge”。
相比于毒力未削弱的68-1 RhCMV/SIV病毒载体,ΔRh110 68-1 RhCMV/SIV病毒载体在体内存在高度传播缺陷(即不能够在体内高效传播),传播能力下降了大约1000倍,但是它们仍然能够重复感染(superinfect)RhCMV阳性恒河猴,并且高频率地产生效应-记忆偏向性的T细胞反应。
这些研究人员证实表达同源或异源SIV抗原的ΔRh110 68-1 RhCMV/SIV病毒载体高度有效地抵抗阴道内SIVmac239病毒(SIV的一种高度致病性的毒株,是一种类似于HIV病毒的非人灵长类动物逆转录病毒)攻击:在59%的接受疫苗(指的是ΔRh110 68-1 RhCMV/SIV病毒载体)接种的恒河猴中,它控制着SIV感染并且渐进性清除SIV。此外,在12只接受疫苗接种后控制着初始SIV攻击并且渐进性清除SIV的恒河猴中,9只恒河猴能够在最后一次疫苗接种大约3年后严格地控制第二次SIV攻击,这证实了这种疫苗的持久性。
2.Science子刊:细胞入侵抑制剂eCD4-Ig有望抵抗高剂量的HIV病毒攻击
doi:10.1126/scitranslmed.aau5409
许多猿猴免疫缺陷病毒(SIV)和猿猴-人类免疫缺陷病毒(SHIV)已被用于评估HIV-1疫苗策略的功效,其中,SIVmac239被认为是最严格的,这是因为与SHIV模型不同的是,它的全基因组在它的恒河猴宿主中经历共同进化,而且它的3级包膜糖蛋白(tier 3 envelope glycoprotein)极难中和。
在一项新的研究中,美国研究人员研究了一种模拟HIV-1和SIV受体和辅助受体的抗体样细胞入侵抑制剂---eCD4-Ig---阻止SIVmac239感染的能力。eCD4-Ig是一种经过修饰的CD4蛋白。相关研究结果发表在2019年7月24日的期刊上,论文标题为“AAV-delivered eCD4-Ig protects rhesus macaques from high-dose SIVmac239 challenges”。
这些研究人员发现由重组腺相关病毒(AAV)载体表达的rh-eCD4-IgI39N让4只恒河猴完全免受高剂量SIVmac239攻击,相比之下,8只对照恒河猴在相同情形下全部受到感染。然而,表达rh-eCD4-IgI39N的恒河猴最终死于一系列升高的SIVmac239攻击剂量,这一系列升高的攻击剂量分别是感染对照恒河猴的攻击剂量的2倍、8倍、16倍和32倍。尽管接受了更大的攻击剂量,这些rh-eCD4-IgI39N恒河猴的病毒载量峰值和峰值后病毒载量显著低于对照恒河猴。有证据表明从这4只表达rh-eCD4-IgI39N的恒河猴中的3只体内分离出的SIV病毒经历较强的来自rh-eCD4-IgI39N的选择性免疫压力。相比于恒河猴CD4,rh-eCD4-IgI39N发生了点突变。为了逃避这种细胞入侵抑制剂的作用,这些分离出的SIV病毒也发生了突变,所发生的突变位于CD4结合位点。在一只表达rh-eCD4-IgI39N的恒河猴中,它们发生的突变利用了rh-eCD4-IgI39N和恒河猴CD4之间的点突变差异逃避这种细胞入侵抑制剂的作用。其他的逃避途径与这种病毒的适应成本(fitness cost)相关。
3.突破!Science子刊报道新型减毒HIV疫苗,安全无毒疗效佳!
doi:10.1126/scitranslmed.aaw2603
一种有望从猴子身上清除艾滋病病毒的疫苗距离人体试验又更近了一步,因为一种新的弱疫苗已被证明可以提供与原疫苗类似的保护。近日发表在《Science Translational Medicine》杂志上的两篇论文描述了这种疫苗--它使用了一种常见的巨细胞疱疹病毒(cytomegalovirus,简称CMV)--是如何被活减毒或削弱的,以便CMV不会轻易传播。这种新的疫苗成功地消灭了59%的接种过疫苗的恒河猴体内的猴免疫缺陷病毒,即猴子版的HIV。这一结果与早期关于原始非减毒疫苗的结果相似。减毒疫苗产生的免疫力也很持久,因为接种疫苗的12只猴子中有9只在3年后仍能抵抗SIV感染。

图片来源:https://cn.bing.com。
疫苗毒性减弱是应用于人类的关键。出于安全考虑,没有疫苗使用非减毒活病毒。虽然人类感染巨细胞病毒后通常没有任何问题,但这种病毒可以对免疫系统薄弱的人造成严重破坏,比如器官移植患者。这对孕妇也是危险的,因为它会导致先天缺陷,如婴儿听力损失和小头畸形。
论文共同通讯作者Klaus fruh博士说:"这项使用恒河猴巨细胞病毒的研究为设计基于人类巨细胞病毒的HIV疫苗提供了潜在的重要理论。我们显着降低了巨细胞病毒毒性,并且仍然得到了与野生版本的这种疫苗相同的免疫反应。"
论文共同通讯作者医学博士Louis Picker说:"这些论文很重要,因为它们总结了之前报道过的独特的CMV载体的功效,该载体具有高度衰减的基因修饰,因此在临床使用中具有潜在的安全性。"此外,新研究还表明,大多数接种过疫苗的恒河猴在首次接种SIV疫苗数年后,也可以免受第二次感染。
4.PLoS Pathog:揭示HIV感染如何导致心脏病、糖尿病和痴呆症等一系列慢性疾病
doi:10.1371/journal.ppat.1007907
在一项新的研究中,来自澳大利亚贝克心脏与糖尿病研究所的研究人员发现由HIV感染的细胞释放出的单个病毒因子可能对身体造成严重破坏,并导致心脏病、糖尿病和痴呆症等慢性的潜在致命性的疾病的产生。这一发现潜在地促进人们开发可能有助于为全球3600万HIV感染者提供更长更健康的生活的靶向疗法。相关研究结果于2019年7月25日的PLoS Pathogens期刊上,论文标题为“Exosomes containing HIV protein Nef reorganize lipid rafts potentiating inflammatory response in bystander cells”。
对HIV/AIDS的治疗是如此先进,以至于HIV感染者的预期寿命与未感染者的预期寿命非常相似。然而,HIV感染者可能会出现心脏病、糖尿病、痴呆症或相关并发症等合并并发症(co-morbidities)。已有研究表明,HIV感染者不仅患这些慢性疾病的风险增加,而且发病年龄较小,疾病进展较快。
这些研究人员发现来自受到HIV感染的细胞的HIV蛋白---Nef---以外泌体(一种特定的胞外囊泡)的形式释放出来,并被未感染的“旁观者”细胞摄取,从而破坏这些细胞中的胆固醇代谢。这种胆固醇代谢受损引发炎症,从而促进痴呆症、心脏病和糖尿病等疾病的产生。
5.Cell Rep:一种新型疫苗阻止HIV感染有戏!
doi:10.1016/j.celrep.2019.06.074
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员开发出一种由DNA和重组蛋白组成的新型疫苗,其中重组蛋白由一种HIV蛋白的一部分和另一种不相关的蛋白组成。这种疫苗在猴子身上进行了测试,测试结果表明它能够诱导出的抗体类似于与抵抗HIV感染相关的抗体。相关研究结果发表在2019年7月23日的Cell Reports期刊上,论文标题为“Multimeric Epitope-Scaffold HIV Vaccines Target V1V2 and Differentially Tune Polyfunctional Antibody Responses”。

图片来自Cell Reports, 2019, doi:10.1016/j.celrep.2019.06.074。
这些研究人员首先鉴定出HIV病毒的一部分,当与抗体结合时,会导致这种病毒和受到它感染的细胞遭受破坏。他们随后设计出一种可诱导这些类型抗体产生的疫苗。这种疫苗设计方法称为“反向疫苗学(reverse vaccinology,也译作逆向疫苗学)”。
这些研究人员鉴定出的HIV病毒靶标称为gp120包膜蛋白上的V1V2环。在针对接受用gp120 DNA和三种携带这种V1V2区域的新型重组蛋白接种的猴子开展的实验中,这种疫苗接种诱导出显示许多不同抗病毒功能的抗体。这些抗体属于在之前的人类临床试验中与HIV感染率下降相关的抗体类型。
6.Nat Immunol:揭示CCR5AS lncRNA多态性影响HIV感染
doi:10.1038/s41590-019-0406-1
在一项新的研究中,美国德州生物医学研究所助理教授Smita Kulkarni博士和美国弗雷德里克国家癌症研究实验室的Mary Carrington博士领导的一个研究团队确定了一种长链非编码RNA(lncRNA)影响一种参与HIV感染和疾病进展的关键受体。这种新鉴定出的机制可能为控制HIV感染开辟了一条新的途径。相关研究结果发表在2019年7月的Nature Immunology期刊上,论文标题为“CCR5AS lncRNA variation differentially regulates CCR5, influencing HIV disease outcome”。
Kulkarni和她的同事们发现一种称为CCR5AS的特定lncRNA影响编码HIV辅助受体CCR5的基因。鉴于CCR5对于HIV病毒侵入细胞至关重要,因此与这种lncRNA的表达变化相关联的多态性会影响HIV感染的结果。来自西班牙裔美国人、非洲裔美国人和日本人等各种群体的基因组DNA表明这种关联性存在于许多种族中。这种关联性在不同人群中的一致性表明存在一种解释这种关联性的单个功能性机制。
7.Nat Immunol:尽管接受ART治疗,大多数HIV感染者的免疫系统仍存在无法修复的漏洞
doi:10.1038/s41590-019-0418-x
2017年,将近3700万人感染上HIV病毒。每天,世界各地的卫生当局报道了5000例新的HIV感染病例。如果不接受抗逆转录病毒疗法(ART),那么大多数HIV患者的免疫系统就会经历渐进性削弱。但是,仅很小比例的患者---0.3%---在不接受ART治疗的情形下自行地控制这种病毒。对这种现象作出的解释部分在于识别HIV的稀有白细胞表达的一组基因吗?在一项新的研究中,来自加拿大蒙特利尔大学医院研究中心的研究人员给出了肯定的答案。相关研究结果于2019年7月15日在线发表在Nature Immunology期刊上,论文标题为“Altered differentiation is central to HIV-specific CD4+ T cell dysfunction in progressive disease”。

图片来自Nature Immunology, 2019, doi:10.1038/s41590-019-0418-x。
CD4 T细胞在协调免疫反应中起着关键作用,是有助于控制HIV病毒等慢性感染的重要白细胞。但是,平均而言,CD4 T细胞群中仅有大约1000个细胞能够识别这种病毒。
论文通讯作者、加拿大蒙特利尔大学医院研究中心研究员、传染病专家Daniel Kaufmann说道,“在我的研究团队和合作者的帮助下,我们全面确定了来自长期感染上HIV的患者的血液的这些罕见细胞表达的全部基因,在这些患者中,在接受ART治疗之前,这种病毒在血液中大量存在。我们随后将这些细胞与来自HIV控制者(HIV controller)---在未接受治疗的情形下,能够控制这种病毒的患者---的细胞进行比较。这种强大的方法,也称为全基因组转录分析,一次测量数千个基因的活性,因而可构建出全局的细胞功能图谱。”
通过使用复杂的细胞分析技术,论文第一作者、Kaufmann实验室博士后研究员Antigoni Morou鉴定出这两组患者之间的主要功能差异。比如,HIV控制者具有更强大的Th17和Th22免疫反应,这对于胃肠道的防御是重要的。但是在具有高水平HIV病毒复制的慢性感染患者中,靶向HIV的CD4 T细胞出现功能失调,而且他们的一些细胞亚群显示出异常功能的迹象。
8.JCI:长期接受抗逆转录病毒治疗的个体中,感染艾滋病毒的细胞持续存在脑脊液中
doi:10.1172/JCI127413
7月15日发表在《Journal of Clinical Investigation》上的一项研究显示,在接受长期抗逆转录病毒治疗(ART)的艾滋病毒阳性患者中,约有一半的人的脑脊液中含有艾滋病毒感染细胞。
医学博士Serena Spudich及其耶鲁大学的同事们研究了HIV在脑脊液中的持久性,以及在长期接受ART治疗期间炎症和神经认知表现的关系。69名参与艾滋病临床试验组HIV携带者队列研究的参与者同时接受了腰椎穿刺、静脉切开术和神经认知评估。在外周血单核细胞和脑脊液细胞微球中检测细胞相关(CA) HIV DNA和RNA,在脑脊液上清液和血浆中检测无细胞HIV RNA。
参与者在接受平均8.6年的ART治疗后接受评估。研究人员发现,在4%、9%和48%的参与者的脑脊液中分别检测到无细胞RNA、CA-RNA和CA-DNA。无细胞脑脊液HIV RNA检测与血浆HIV RNA检测存在相关性。脑脊液炎症标志物与HIV持续性检测结果无相关性。即使在调整了年龄和CD4最低点计数之后,研究人员仍然发现CSF CA-DNA检测与更糟的神经认知结果(包括全球缺陷评分)之间存在相关性。
9.Nat Metabol:研究揭示CD8抵抗HIV感染的机制,成功重编程CD8细胞清除HIV
doi.org/10.1038/s42255-019-0081-4
近15年来,天然抵抗艾滋病毒感染的罕见个体的细胞一直是研究的重点,目的是阐明它们的具体特征。在对ANRS CO21 CODEX和CO6 PRIMO的研究之后,巴斯德研究所的科学家描述了这些"HIV控制器"研究对象中CD8免疫细胞的特征。这些免疫细胞独特的抗病毒能力可以归因于一个最佳的代谢程序,它提供了持久性和对感染细胞作出有效反应的能力。在体外工作时,科学家们成功地对受感染的非控制者的细胞进行了重新编程,使它们具有与控制者细胞相同的抗病毒能力。他们的研究结果于近日发表在《Nature Metabolism》杂志上。
有些人无需治疗就能自然控制艾滋病毒。在这些非常罕见的个体中(不到1%的艾滋病毒感染者),在未经治疗的情况下,在感染超过10年后血液中仍然无法检测到病毒的增殖。2007年,巴斯德研究所的科学家描述了这些患者CD8淋巴细胞的抗病毒活性。与非控制者不同,HIV控制者的CD8细胞能够迅速摧毁受感染的CD4细胞。
可以控制HIV的患者的CD8细胞(或"记忆细胞")表面上看起来与不可控制HIV的患者的相同。但是科学家们证明了他们有一个不同的分子程序。他们的研究表明,控制者体内的抗HIV CD8细胞不仅具有巨大的抗病毒潜力;它们也被编程以持续生存,而在非控制者体内,细胞程序使它们易于衰竭和细胞死亡。
10.Science子刊:揭示抗逆转录病毒药物在三种物种肠道中的不均匀分布
doi:10.1126/scitranslmed.aap8758
携带残留HIV病毒的组织(包括肠道)未能充分地暴露于抗逆转录病毒药物(ART)中可能导致HIV的持久存在。这可能导致组织中的HIV病毒复制增加。测量组织中药物浓度的传统方法无法表征药物的不均匀分布。
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校、俄勒冈健康与科学大学、科罗拉多州立大学、加州大学戴维斯分校、北卡罗莱纳州立大学和弗雷德里克国家癌症研究实验室的研究人员利用质谱成像(mass spectrometry imaging, MSI)技术可视化观察6种ART药物在来自三种物种(两种人源化小鼠品系、恒河猴和人类)的肠道组织切片中的分布。相关研究结果发表在2019年7月3日的Science Translational Medicine期刊上,论文标题为“Heterogeneous antiretroviral drug distribution and HIV/SHIV detection in the gut of three species”。

关于受HIV感染的T细胞的扫描电镜图,图片来自NIAID。
这些研究人员测量了HIV靶向的CD3+ T细胞附近的药物浓度,以及在来自HIV感染的人源化小鼠、SHIV感染的恒河猴和HIV感染的人类患者在接受ART药物联合治疗后的肠道组织中的HIV或SHIV RNA表达和MDR1药物外排转运蛋白的表达。他们利用质谱成像技术可视化观察速冻的回肠和直肠组织的连续10μm切片,并且通过免疫荧光和免疫组织化学分别分析这些组织切片中的CD3+ T细胞和MDR1药物外排转运蛋白表达。他们利用原位杂交分析方法分析了这些组织切片中的HIV/SHIV RNA表达,并且利用液相色谱-质谱联用技术测量了ART药物浓度。基于这些测量结果,他们发现这六种ART药物在胃肠道组织中的分布是不均匀的。50%~60%的CD3+ T细胞未能与肠道组织中可检测到的药物浓度共存。
这些研究人员发现在这三种物种中,在ART药物治疗期间,仍然能够检测到HIV/SHIV RNA,特别是在ART药物浓度较低的组织区域,这可能导致低水平的HIV/SHIV病毒复制。特别地,他们发现高达90%的HIV/SHIV RNA在没有接触ART药物的肠道组织中表达。
11.JAHA:HIV感染增加心力衰竭和中风风险
doi:10.1161/JAHA.119.012241
在一项新的研究中,来自美国埃默里大学和乔治亚州立大学的研究人员在对来自一个大型健康保险数据库的信息进行分析后,发现HIV患者患上心血管疾病(CVD)---特别是心力衰竭和中风---的风险较高。这一发现表明需要加大力度保护这些患者的心血管健康。相关研究结果发表在2019年7月16日的Journal of the American Heart Association期刊上,论文标题为“HIV Infection and Incidence of Cardiovascular Diseases: An Analysis of a Large Healthcare Database”。
在这项研究中,这些研究人员分析了19798名HIV感染者以及59302名年龄和性别匹配的未感染者的信息,并且对这些人平均随访20个月。HIV感染者患心力衰竭和中风的风险分别高出3.2倍和2.7倍。
HIV感染与心血管疾病之间的关联性对于年龄小于50岁的人和没有心血管疾病史的人尤为强烈。HIV感染者患外周动脉疾病的风险并未增加,而且他们的心脏病发作或心房颤动的风险也只有中度增加。
12.Nat Commun:HIV研究新发现!CD11c+树突细胞或是机体HIV感染的一线免疫细胞
doi:10.1038/s41467-019-10697-w
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自西米德医学研究所(Westmead Institute for Medical Research)的科学家们通过研究发现,全新的免疫细胞或许处于HIV感染的前线,这些名为CD11c+的树突细胞对于HIV的感染非常易感,而且能将病毒传染给其它细胞。
CD11c+ 树突细胞是一类树突细胞(一类免疫细胞),其仅存在于人类的生殖器组织中,尤其是阴道、内包皮和肛门的上皮组织中(形成表面的组织薄层),在生殖器组织中的定位意味着,这些新发现的CD11c+ 树突细胞或许就是与HIV相互作用的第一批免疫细胞。研究者Andrew Harman教授表示,CD11c+ 树突细胞所扮演的角色就是捕获任何进入机体的病原体,随后再将病原体传递给CD4 T细胞。CD4 T细胞主要负责驱动机体对病原体的免疫反应,更有意思的是,其也是病毒进行复制的主要HIV靶向性细胞。

图片来源:The Westmead Institute for Medical Research。
一旦树突细胞捕获病原体,其就会与淋巴结中的CD4 T细胞相互沟通,并让机体免疫系统不断更新,这些信息就会使得免疫系统做好准备,要么对细菌或病毒耐受,要么对其发起攻击。然而,如果CD4 T细胞的水平降低到临界水平以下,机体就无法产生足够的免疫反应来抵御HIV了。
如今研究人员发现,相比其它已知的树突细胞而言,CD11c+ 树突细胞对于HIV感染的易感性较强,而且CD11c+ 树突细胞与CD4 T细胞相互作用要比其它树突细胞更为有效;更重要的是,CD11c+ 树突细胞能将病毒传递给CD4 T细胞,使其成为HIV感染的关键驱动器,由于这些树突细胞能与CD4 T细胞发生有效的相互作用,因此其就能够成为开发疫苗的重要候选细胞。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


