新型抗真菌药!脂质纳米晶体配方MAT2203(口服两性霉素B)获美国FDA第4项QIDP和快速通道资格
来源:本站原创 2019-07-27 16:33
2019年07月27日/生物谷BIOON/--Matinas BioPharma是一家临床阶段的生物制药公司,专注于发现和开发治疗各种感染的抗真菌和抗细菌疗法。近日,该公司宣布,美国食品和药物管理局(FDA)已授予其专有的口服两性霉素B产品MAT2203治疗隐球菌性脑膜炎的合格传染病产品资格(QIDP)和快速通道资格(FTD)。之前,FDA已授予MAT2203治疗其他三种适应症的QIDP和FTD,

2019年07月27日/生物谷BIOON/--Matinas BioPharma是一家临床阶段的生物制药公司,专注于发现和开发治疗各种感染的抗真菌和抗细菌疗法。近日,该公司宣布,美国食品和药物管理局(FDA)已授予其专有的口服两性霉素B产品MAT2203治疗隐球菌性脑膜炎的合格传染病产品资格(QIDP)和快速通道资格(FTD)。之前,FDA已授予MAT2203治疗其他三种适应症的QIDP和FTD,包括:预防免疫抑制疗法引起的侵袭性真菌感染、治疗侵袭性念珠菌病、治疗侵袭性曲霉菌病。
QIDP资格认定意味着,在成功完成临床项目后,MAT2203将获得优先审查权。而快速通道地位旨在促进FDA和制药公司在药物开发上的沟通和协作。QIDP是2012年7月美国《FDA安全与创新法案》(FDA Safety and Innovation Act)下GIAN法案产生的新药特批通道,旨在激励抗生素研发,以应对严重威胁生命的细菌感染。简单地说,QIDP=研究阶段快速通道(fast track)+审批阶段优先审评(priority review)+上市后5年额外市场独占权。
目前,静脉注射(IV)两性霉素B具有很好的治疗效果、甚至没有临床耐药性,这是一种重要的广谱杀菌剂,但具有显著的治疗限制性副作用,最显著的是肾脏毒性。
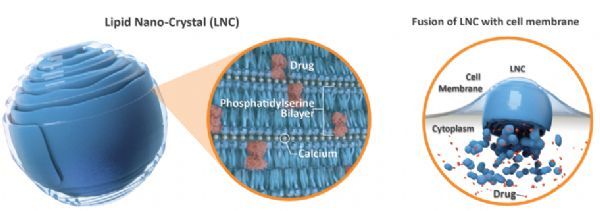
MAT2203是一种两性霉素B(一种广谱杀菌剂)的口服制剂,是利用Matinas公司专有的脂质纳米晶体(LNC)递送技术平台创造出的一种潜在耐受性更好、使用更方便的杀菌剂,具有一种吸收和分布到受感染组织的新机制,有潜力改变两性霉素B这种强效杀菌剂的使用方式,而且不存在历史上与限制两性霉素B使用相关的毒性作用。
在对48例健康志愿者开展的一项单剂量、双盲、剂量递增、药代动力学设计I期临床研究中,MAT2203显示出了很强的安全性和耐受性,没有严重不良事件或观察到肾脏毒性。美国国立卫生研究院(NIH)对MAT2203开展的II期研究表明,3例入组患者全部达到了主要疗效终点,其中2例患者已成功接受MAT2203治疗超过一年时间,且没有与两性霉素B使用相关的肾脏或其他毒性证据。
基于治疗耐药病原菌的潜力、安全特性/有限的药物与药物相互作用(支持预防性应用),MAT2203有潜力成为预防和治疗侵袭性真菌感染(IFI)的同类最佳疗法,缩短住院时间、降低门诊费用。
隐球菌性脑膜炎是一种危及生命的疾病,最常见于免疫功能低下的个体。Matinas公司首席执行官Jerome D.Jabbour表示:“隐球菌性脑膜炎已成为人类免疫缺陷病毒(HIV)患者中最常见、最致命的机会性感染之一。此次QIDP和FTD是MAT2203临床项目在监管方面的另一个重要进展。如果MAT2203获得FDA批准,则Matinas公司将有资格在隐球菌性脑膜炎适应症中获得额外五年的营销独占权。目前,我们正计划在美国国立卫生研究院(NIH)的全额资助下,启动MAT2203治疗隐球菌性脑膜炎的首个临床研究。我们认为该项研究将是对我们独特的药物传递平台能力的一个重要证明,包括将治疗药物穿过血脑屏障的重要潜力,这可能具有深远的意义。”
脂质纳米晶体(LNC)技术
除了MAT2203之外,Matinas公司管线中还有一款药物MAT2501,这是一种经口服给药的、LNC配方的广谱氨基糖苷类抗生素阿米卡星(amikacin)。目前,阿米卡星仅有静脉注射制剂,用于治疗不同类型的慢性和急性细菌性感染,包括非结核性分支杆菌(NTM)感染、多药耐药革兰氏阴性菌感染。静脉注射制剂阿米卡星与重大的副作用相关,包括肾脏毒性和耳毒性(永久性听力丧失)。
MAT2501旨在提供强效抗生素阿米卡星的靶向递送,同时显著提高安全性和耐受性。在临床前研究中,MAT2501口服给药治疗肺和弥漫性NTM感染小鼠模型证实了疗效。之前,FDA也授予了MAT2501治疗NTM感染的QIDP和孤儿药资格。
2017年5月,Matinas公司完成并公布了健康志愿者中MAT2501的一项I期单剂量递增临床研究的顶线结果。在该项研究中,未报告严重不良事件,并且在所有试验剂量下口服MAT2501产生的血液水平远低于静脉注射阿米卡星推荐的安全水平,支持了进一步开发MAT2501用于NTM感染的治疗。如果获得批准,MAT2501将成为第一个口服生物可利用氨基糖苷,从治疗和健康经济的角度来看,它将代表对现有疗法的显著改进。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->