研究发现一氧化氮响应环境变化诱导运动可塑性的**机制
来源:动物所 2019-07-06 21:27
一氧化氮(NO)是一种气体信使分子,已被揭示在心脑血管调节、神经、免疫调节、运动能力等方面发挥重要作用。一氧化氮合成酶(NOS)是NO合成过程的关键限速酶,直接调控细胞中的NO含量。目前,在脊椎动物中已经发现三种NOS 编码基因(neural NOS, inducible NOS, epitheial NOS),其转录调控机制已被陆续报道。然而,在较低等的无脊椎动物中只发现了一种NOS编码基因,其
一氧化氮(NO)是一种气体信使分子,已被揭示在心脑血管调节、神经、免疫调节、运动能力等方面发挥重要作用。一氧化氮合成酶(NOS)是NO合成过程的关键限速酶,直接调控细胞中的NO含量。目前,在脊椎动物中已经发现三种NOS 编码基因(neural NOS, inducible NOS, epitheial NOS),其转录调控机制已被陆续报道。然而,在较低等的无脊椎动物中只发现了一种NOS编码基因,其转录调控机制鲜有报道。
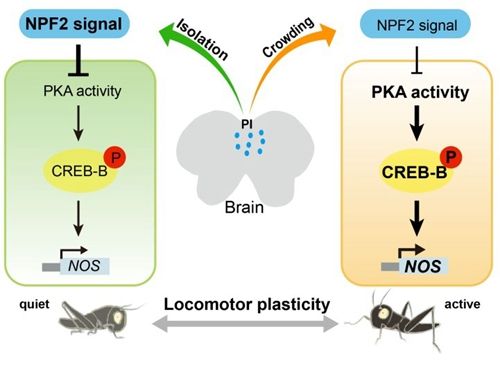
中国科学院动物研究所王宪辉研究组前期工作发现飞蝗中两个同源神经肽F,NPF1a及NPF2,以一种类似“双保险”的刹车机制,分别在磷酸化水平和转录水平上抑制一氧化氮合成酶(NOS)的活性,降低NO含量,进而调控飞蝗型变过程中的运动可塑性(Hou et al, 2017, eLife)。最近,研究人员进一步揭示出一个重要的转录因子CREB-B,介导了NPF2对NOS转录的抑制作用,参与飞蝗运动可塑性的调控。CREB-B与NOS共定位于飞蝗脑部负责整合感觉与运动的前脑桥区。CREB-B蛋白的110位丝氨酸磷酸化动态地响应飞蝗种群密度的变化,并受到神经肽NPF2的负调控。在群居飞蝗中干扰CREB-B基因显着降低飞蝗的运动活性,在散居飞蝗中干扰CREB-B则可以阻断NPF2基因沉默对运动活性的促进作用。蛋白激酶A(PKA)介导了NPF2对CREB-B磷酸化和NOS转录水平的抑制作用。该项研究首次报道昆虫中NOS基因的转录调控机制,揭示了NPF2/PKA/CREB-B/NOS这一信号通路对飞蝗运动可塑性的精确调控,为理解NO含量响应环境变化的分子基础及运动可塑性发生机制提供了重要的线索。
该文章于5月31日以CREB-B acts as a key mediator of NPF/NO pathway involved in phase-related locomotor plasticity in locusts 为题在线发表于PLoS Genetics 杂志(doi: 10.1371/journal.pgen.1008176)。第一作者为助理研究员侯丽,通讯作者为研究员王宪辉和康乐。该课题得到中科院先导B项目和国家自然科学基金委项目的资助。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


