梳理肝脏再生研究进展
来源:本站原创 2019-06-29 20:03
2019年6月29日讯/生物谷BIOON/---肝脏是身体内以代谢功能为主的一个器官,并在身体里面起着去氧化、储存肝糖、分泌性蛋白质的合成等作用。肝脏也制造消化系统中之胆汁。在人体的所有器官中,肝脏的再生能力最为强大。至于肝脏如何进行自我修复及再生,专家学者们尚未得到统一的结果。一项新进研究揭示了一种不明细胞对肝脏再生具有重要意义,它可以使肝脏组织得以再生却不会形成肿瘤。这些新发现的细胞也称为肝细
2019年6月29日讯/生物谷BIOON/---肝脏是身体内以代谢功能为主的一个器官,并在身体里面起着去氧化、储存肝糖、分泌性蛋白质的合成等作用。肝脏也制造消化系统中之胆汁。
在人体的所有器官中,肝脏的再生能力最为强大。至于肝脏如何进行自我修复及再生,专家学者们尚未得到统一的结果。一项新进研究揭示了一种不明细胞对肝脏再生具有重要意义,它可以使肝脏组织得以再生却不会形成肿瘤。这些新发现的细胞也称为肝细胞,但是它的功能比普通的肝细胞更强大。在既往研究中,研究人员认为肝脏中的一类成体干细胞即卵圆细胞在肝脏的再生功能中发挥着重要作用,但是后续研究证实卵圆细胞最后分化为胆管细胞。基于此,小编针对肝细胞再生研究近年来取得的进展进行一番盘点,以飨读者。
1.Blood:为何人类机体的肝脏无法再生?
doi:10.1182/blood-2018-08-869057
肝脏是机体中唯一能够再生的器官,但有些经历肝脏切除术的患者最终却需要肝脏移植来治疗,因为其机体中肝脏再生的过程并不会发挥作用;近日,一项刊登在国际杂志Blood上的研究报告中,来自密歇根州立大学科学家们通过研究发现,名为纤维蛋白原的血凝蛋白或有望帮助解释为何部分患者机体肝脏无法进行正常的再生过程。
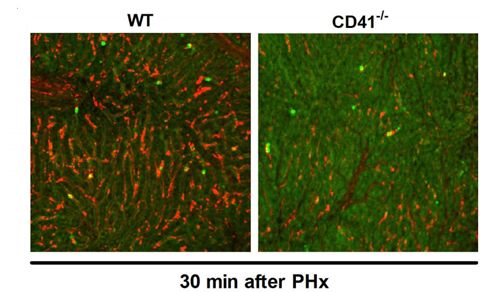
研究者James Luyendyk教授说道,我们发现,患者术后纤维蛋白原能够在剩余肝脏组织中快速积累,并告知血小板扮演首个响应者的角色,从而诱发最开始的再生阶段;但如果纤维蛋白原和血小板的功能受到抑制的话,患者肝脏再生的过程就会延迟。
血小板是一种帮助产生凝血阻断机体流血的血细胞,当其接收到来自纤维蛋白原的信息时,其就会开始行动并在患者剩余的肝脏中开始积累来帮助修复并再生肝脏,从而就能增加产生完整功能性肝脏及患者完全康复的机会。利用接受肝脏切除患者和类似小鼠模型机体中的样本进行研究,研究人员注意到,当纤维蛋白原水平较低时,肝脏中血小板的数量就会降低。这就表明,在小鼠和人类机体中,纤维蛋白原的沉着对于直接影响肝脏再生至关重要。
据研究者介绍,纤维蛋白原的水平是一种重要的预测标志物,测定肝脏切除患者机体中纤维蛋白原的水平或能帮助研究人员确定患者机体的器官是否能够成功再生或者继续保持异常功能状态;本文研究结果会能帮助研究人员开发新型疗法,帮助临床医生在手术过程中使用纤维蛋白原浓缩物来纠正该蛋白质的水平。
2.Nature:肝脏细胞如何转化身份来进行组织损伤修复?
doi:10.1038/s41586-018-0075-5
通过对一种名为阿拉吉欧综合症(Alagille syndrome)的罕见肝脏疾病进行研究,近日,来自加利福尼亚大学辛辛那提儿童医院的研究人员通过研究发现了一种不寻常组织再生背后的分子机制,相关研究刊登于国际杂志Nature上,该研究或未来有望帮助减少器官移植所需的费用及器官无法获取等问题。
研究者表示,当疾病或损伤导致一种关键类型肝细胞的缺失时,器官就会指导另外一种类型的肝细胞来改变身份作为替代,这一研究发现是在老鼠机体中进行的,未来其有望成为治疗多种人类疾病的一种可行性手段。如果后续研究成功的话,医学界很有可能会获得另外一种修复组织损伤的方法,而这种方法并不需要通过操控培养皿中的干细胞来生长成为器官。
研究者Stacey Huppert说道,长期以来我们一直知道相比其它器官而言,肝脏更有能力进行再生,而最近我们又利用特殊工具对肝脏再生的能力进行了深度研究;本文研究结果表明,肝细胞的形成和功能实际上具有更大的灵活性,其能够提供大部分肝脏功能,这种灵活性就能为研究人员提供机会开发治疗多种肝脏疾病的新型疗法。
3.Nature:重大突破!表达端粒酶的肝细胞可再生肝脏
doi:10.1038/s41586-018-0004-7
在一项新的研究中,来自美国斯坦福大学医学院的研究人员发现在正常细胞更新或组织损伤期间,表达高水平端粒酶的肝干细胞在小鼠中起着再生肝脏器官的作用。端粒酶是一种通常与抗衰老相关的蛋白。这些肝干细胞分布在整个肝叶中,使得不论这种损伤的位置发生在哪里,它们都能够快速地自我修复。了解肝脏的这种修复和再生的卓越能力是理解这种器官停止发挥功能(如在肝硬化或肝癌病例中观察到的那样)的关键步骤。相关研究结果于2018年4月4日在线发表在Nature期刊上,论文标题为“Distributed hepatocytes expressing telomerase repopulate the liver in homeostasis and injury”。

论文通信作者、医学教授Steven Artandi博士说,“肝脏是人类疾病的重要来源。理解肝脏自我更新的细胞机制至关重要。我们发现这些罕见的增殖性细胞遍布整个肝脏器官,而且它们有助于肝脏替换受损的细胞。我们认为当对这些细胞的调控发生差错时,它们也可能会导致肝癌。”
论文第一作者、博士后研究员Shengda Lin博士发现在小鼠中,大约3%~5%的肝细胞表达异常高水平的端粒酶。这些细胞表达较低水平的参与正常细胞代谢的基因,它们均匀地分布于肝小叶。在正常的细胞更新期间或肝脏受损后,这些细胞在适当的位置发生增殖,形成新的肝细胞团块。
这些罕见的细胞能够经激活后发生分裂,并且在整个肝脏形成细胞克隆。随着成熟的肝细胞死亡,这些细胞克隆替换肝脏质量。但是它们在原地工作,它们不会被招募到肝脏的其他地方。这可能解释着不论肝脏在何处遭受损伤,它如何快速地修复这种损伤。
当Lin对表达端粒酶的小鼠肝细胞进行基因改造,使得它们对一种化学信号作出反应而死掉,然后给小鼠提供一种造成肝脏损伤的化学物,他发现相比于这些表达端粒酶的细胞发挥功能的那些小鼠,这些表达端粒酶的细胞已被杀死的那些小鼠产生更加严重的肝脏瘢痕。
4.Nature:科学家们发现肝脏再生的新机制
doi:10.1038/nature23015
最近,研究者们首次发现了胆囊上皮细胞"cholangiocytes"在肝脏再生中的作用,这项研究对于肝脏的再生医学研究已经肝脏疾病的治疗具有重要的意义。相关结果发表在《Nature》杂志上。
最近,研究者们利用hepatocytes分裂缺陷型小鼠作为试验对象,并且通过人为诱导肝脏损伤研究其它类型的细胞对肝脏再生的作用。结果显示,胆囊的上皮细胞同样参与了肝脏的再生过程。此外,科学家们还认为cholangiocytes分裂对于肝脏再生的贡献要大于hepatocytes。
该文章的作者,来自Skoltech转化医学研究中心的主任Yuri Kotelevtsev,称:"几年前,我与来自爱丁堡大学的同事们进行科学项目合作。期间我告诉他们,我们的研究中心正在开发肝脏基因的敲除技术。这项技术虽然在几年前就已经被熟知,但真正的应用还十分有限。而当时Stuart Forbes教授正致力于研究胆囊上皮细胞对于肝脏再生作用的研究。我们通过siRNA的手段阻断了hepatocytes 细胞中b1 intergrin的表达,从而发现了cholangiocytes促进肝脏再生的现象。目前,我们正在与Forbes实验室进行合作,试图寻找新的基因靶点,希望能够在阻断其表达之后缓解肝脏纤维化以及肝硬化等症状"。
5.Cell:揭示体细胞突变促进肝脏组织再生
doi:10.1016/j.cell.2019.03.026
正常组织随着年龄的增长而累积遗传变化,但是在慢性退行性疾病的情况下,体细胞突变是否促进非恶性细胞的克隆扩增(clonal expansion)尚不清楚。在一项新的研究中,来自美国国家糖尿病、消化与肾疾病研究所和德克萨斯大学西南医学中心的研究人员通过对来自82名患者的患病肝脏样本进行外显子组测序,揭示出肝硬化中的复杂突变景观。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“Somatic Mutations Increase Hepatic Clonal Fitness and Regeneration in Chronic Liver Disease”。

进一步的超深度测序鉴定出PKD1、PPARGC1B、KMT2D和ARID1A基因发生频发突变(recurrent mutation)。细胞突变体克隆的数量和大小随着肝脏纤维化阶段和组织损伤的增加而增加。
为了研究突变基因的功能影响,这些研究人员建立了一种合并的体内CRISPR筛选方法。与测序结果一致的是,对147个基因的检测再次表明Pkd1、Kmt2d和Arid1a的缺失促进了克隆扩增。在小鼠中,这些基因的条件性杂合缺失在组织损伤检测中也具有保肝作用。癌变前的体细胞突变通常从癌症的视角来观察,但是他们证实突变能够促进肝脏组织再生,而可能与癌症发生无关。
6.Arch Toxicol:干细胞+3D打印,可用于肝脏移植
doi:10.1007/s00204-018-2280-2
来自爱丁堡大学医学研究委员会(MRC)再生医学中心的科学家结合干细胞技术与3D打印技术,成功培育出了人源3D肝脏组织,并且在小鼠水平显示出治疗的潜力。科学家表示,除了为开发人体肝脏组织植入物方面进行早期的探索,这一研究还可以通过搭建平台来研究人类肝脏疾病以及实验室中的测试药物的药效,从而减少对动物研究的需求。在这项发表在《Archives of Toxicology》杂志上的研究中,科学家们采集了人类胚胎干细胞并诱导形成多能干细胞(已被诱导转变为干细胞的成体细胞),通过定向诱导形成为肝细胞。
科学家们与材料化学家和工程师合作,确定了已经批准用于人体的合适聚合物,以便将它们发展成3-D支架。最好的材料是可生物降解的聚酯聚己内酯,它被制作成微观纤维,纤维网形成一厘米见方,毫米厚的支架。之后,将源自胚胎干细胞的肝细胞(其已在培养物中生长20天)加载到支架上并植入小鼠皮下。
研究结果显示,血管能够在支架上成功生长。此外,作者并且发现小鼠的血液中含有人肝蛋白,表明组织已成功地与循环系统整合,支架未被动物的免疫系统拒绝。进一步,作者在在患有酪氨酸血症的小鼠中测试肝组织支架的效果。酪氨酸血症是一种潜在致命的遗传疾病,其中肝脏中分解氨基酸酪氨酸的酶是有缺陷的,导致有毒代谢产物的积累。
研究结果表明,植入的肝组织能够帮助酪氨酸血症的小鼠分解酪氨酸。与接受空支架的对照组中的小鼠相比,移植有3D打印肝脏组织的小鼠体重减轻,血液中毒素积累较少,并且肝损伤迹象较少。
7.Sci Trans Med:工程化肝脏组织移植后成功扩增
doi:10.1126/scitranslmed.aah5505
许多疾病,包括肝硬化与肝炎等等,都会导致肝脏衰竭的发生。目前美国境内有超过17000名患者受到肝脏衰竭的困扰,焦急地等待肝脏移植。然而,可用的肝脏供体却供小于求。
为了解决供体短缺的问题,研究者们成功地开发出了工程化的肝脏组织。即通过将三种不同类型的细胞包被在可降解的生物活性组织框架中。在小鼠的肝脏损伤疾病模型中,研究者们发现,这一工程化的肝脏在移植进入小鼠腹腔之后,能够扩增50倍左右,并最终能够行使完整的肝脏功能。
这一工程化的肝脏能够帮助数百万饱受慢性肝脏疾病折磨,却苦于没有合适供体的患者带来了福音。相关结果发表在最近一期的《Science Translational Medicine》杂志上。
"这些患者并不急需供体移植,但的确患有肝脏疾病,如果工程化的肝脏能够最终进入临床,那么将会同时为这些患者提供帮助",该文章的作者Kelly Stevens博士说道。
8.Nature:重磅!开发出模拟自然发育的生物工程人肝脏组织
doi:10.1038/nature22796
在一项新的研究中,来自德国、美国和日本的研究人员利用他们开发出的生物工程人肝脏组织发现了之前未知的控制肝脏器官发育过程的分子-细胞交谈网络,这极大地促进利用人多能性干细胞产生健康的可使用的人肝脏组织的努力。他们报道,在临床试验中测试他们的生物工程人肝脏组织之前,仍然需要对它们开展进一步的分子微调。相关研究结果于2017年6月14日在线发表在Nature期刊上,论文标题为“Multilineage communication regulates human liver bud development from pluripotency”。论文通信作者为美国辛辛那提儿童医学中心肠胃病、肝脏与营养科研究员Takanori Takebe博士、德国马克斯-普朗克进化人类学研究所研究员Barbara Treutlein博士和日本横滨市立大学医学研究生院再生医学系研究员Keisuke Sekine博士。
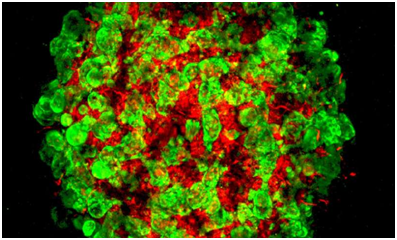
当前治疗晚期肝病的唯一方法是肝脏移植,然而从死亡供者体内获得的肝脏数量是有限的。基于这一点,再生医学的一个主要目标是获得自我组装的人组织,即细胞在准确的时间和空间经历一系列协调的分子事件,从而形成功能性的三维肝芽(liver bud)。
阐明胚胎内胚层发育中的分子-细胞交谈的详细细节和环境对这种技术的治疗潜力是至关重要的。肝脏是在胚胎内胚层中形成的。(生物谷 Bioon.com)
在人体的所有器官中,肝脏的再生能力最为强大。至于肝脏如何进行自我修复及再生,专家学者们尚未得到统一的结果。一项新进研究揭示了一种不明细胞对肝脏再生具有重要意义,它可以使肝脏组织得以再生却不会形成肿瘤。这些新发现的细胞也称为肝细胞,但是它的功能比普通的肝细胞更强大。在既往研究中,研究人员认为肝脏中的一类成体干细胞即卵圆细胞在肝脏的再生功能中发挥着重要作用,但是后续研究证实卵圆细胞最后分化为胆管细胞。基于此,小编针对肝细胞再生研究近年来取得的进展进行一番盘点,以飨读者。
1.Blood:为何人类机体的肝脏无法再生?
doi:10.1182/blood-2018-08-869057
肝脏是机体中唯一能够再生的器官,但有些经历肝脏切除术的患者最终却需要肝脏移植来治疗,因为其机体中肝脏再生的过程并不会发挥作用;近日,一项刊登在国际杂志Blood上的研究报告中,来自密歇根州立大学科学家们通过研究发现,名为纤维蛋白原的血凝蛋白或有望帮助解释为何部分患者机体肝脏无法进行正常的再生过程。

图片来自Blood, 2019, doi:10.1182/blood-2018-08-869057。
研究者James Luyendyk教授说道,我们发现,患者术后纤维蛋白原能够在剩余肝脏组织中快速积累,并告知血小板扮演首个响应者的角色,从而诱发最开始的再生阶段;但如果纤维蛋白原和血小板的功能受到抑制的话,患者肝脏再生的过程就会延迟。
血小板是一种帮助产生凝血阻断机体流血的血细胞,当其接收到来自纤维蛋白原的信息时,其就会开始行动并在患者剩余的肝脏中开始积累来帮助修复并再生肝脏,从而就能增加产生完整功能性肝脏及患者完全康复的机会。利用接受肝脏切除患者和类似小鼠模型机体中的样本进行研究,研究人员注意到,当纤维蛋白原水平较低时,肝脏中血小板的数量就会降低。这就表明,在小鼠和人类机体中,纤维蛋白原的沉着对于直接影响肝脏再生至关重要。
据研究者介绍,纤维蛋白原的水平是一种重要的预测标志物,测定肝脏切除患者机体中纤维蛋白原的水平或能帮助研究人员确定患者机体的器官是否能够成功再生或者继续保持异常功能状态;本文研究结果会能帮助研究人员开发新型疗法,帮助临床医生在手术过程中使用纤维蛋白原浓缩物来纠正该蛋白质的水平。
2.Nature:肝脏细胞如何转化身份来进行组织损伤修复?
doi:10.1038/s41586-018-0075-5
通过对一种名为阿拉吉欧综合症(Alagille syndrome)的罕见肝脏疾病进行研究,近日,来自加利福尼亚大学辛辛那提儿童医院的研究人员通过研究发现了一种不寻常组织再生背后的分子机制,相关研究刊登于国际杂志Nature上,该研究或未来有望帮助减少器官移植所需的费用及器官无法获取等问题。
研究者表示,当疾病或损伤导致一种关键类型肝细胞的缺失时,器官就会指导另外一种类型的肝细胞来改变身份作为替代,这一研究发现是在老鼠机体中进行的,未来其有望成为治疗多种人类疾病的一种可行性手段。如果后续研究成功的话,医学界很有可能会获得另外一种修复组织损伤的方法,而这种方法并不需要通过操控培养皿中的干细胞来生长成为器官。
研究者Stacey Huppert说道,长期以来我们一直知道相比其它器官而言,肝脏更有能力进行再生,而最近我们又利用特殊工具对肝脏再生的能力进行了深度研究;本文研究结果表明,肝细胞的形成和功能实际上具有更大的灵活性,其能够提供大部分肝脏功能,这种灵活性就能为研究人员提供机会开发治疗多种肝脏疾病的新型疗法。
3.Nature:重大突破!表达端粒酶的肝细胞可再生肝脏
doi:10.1038/s41586-018-0004-7
在一项新的研究中,来自美国斯坦福大学医学院的研究人员发现在正常细胞更新或组织损伤期间,表达高水平端粒酶的肝干细胞在小鼠中起着再生肝脏器官的作用。端粒酶是一种通常与抗衰老相关的蛋白。这些肝干细胞分布在整个肝叶中,使得不论这种损伤的位置发生在哪里,它们都能够快速地自我修复。了解肝脏的这种修复和再生的卓越能力是理解这种器官停止发挥功能(如在肝硬化或肝癌病例中观察到的那样)的关键步骤。相关研究结果于2018年4月4日在线发表在Nature期刊上,论文标题为“Distributed hepatocytes expressing telomerase repopulate the liver in homeostasis and injury”。

图片来自Nature, doi:10.1038/s41586-018-0004-7。
论文第一作者、博士后研究员Shengda Lin博士发现在小鼠中,大约3%~5%的肝细胞表达异常高水平的端粒酶。这些细胞表达较低水平的参与正常细胞代谢的基因,它们均匀地分布于肝小叶。在正常的细胞更新期间或肝脏受损后,这些细胞在适当的位置发生增殖,形成新的肝细胞团块。
这些罕见的细胞能够经激活后发生分裂,并且在整个肝脏形成细胞克隆。随着成熟的肝细胞死亡,这些细胞克隆替换肝脏质量。但是它们在原地工作,它们不会被招募到肝脏的其他地方。这可能解释着不论肝脏在何处遭受损伤,它如何快速地修复这种损伤。
当Lin对表达端粒酶的小鼠肝细胞进行基因改造,使得它们对一种化学信号作出反应而死掉,然后给小鼠提供一种造成肝脏损伤的化学物,他发现相比于这些表达端粒酶的细胞发挥功能的那些小鼠,这些表达端粒酶的细胞已被杀死的那些小鼠产生更加严重的肝脏瘢痕。
4.Nature:科学家们发现肝脏再生的新机制
doi:10.1038/nature23015
最近,研究者们首次发现了胆囊上皮细胞"cholangiocytes"在肝脏再生中的作用,这项研究对于肝脏的再生医学研究已经肝脏疾病的治疗具有重要的意义。相关结果发表在《Nature》杂志上。
最近,研究者们利用hepatocytes分裂缺陷型小鼠作为试验对象,并且通过人为诱导肝脏损伤研究其它类型的细胞对肝脏再生的作用。结果显示,胆囊的上皮细胞同样参与了肝脏的再生过程。此外,科学家们还认为cholangiocytes分裂对于肝脏再生的贡献要大于hepatocytes。
该文章的作者,来自Skoltech转化医学研究中心的主任Yuri Kotelevtsev,称:"几年前,我与来自爱丁堡大学的同事们进行科学项目合作。期间我告诉他们,我们的研究中心正在开发肝脏基因的敲除技术。这项技术虽然在几年前就已经被熟知,但真正的应用还十分有限。而当时Stuart Forbes教授正致力于研究胆囊上皮细胞对于肝脏再生作用的研究。我们通过siRNA的手段阻断了hepatocytes 细胞中b1 intergrin的表达,从而发现了cholangiocytes促进肝脏再生的现象。目前,我们正在与Forbes实验室进行合作,试图寻找新的基因靶点,希望能够在阻断其表达之后缓解肝脏纤维化以及肝硬化等症状"。
5.Cell:揭示体细胞突变促进肝脏组织再生
doi:10.1016/j.cell.2019.03.026
正常组织随着年龄的增长而累积遗传变化,但是在慢性退行性疾病的情况下,体细胞突变是否促进非恶性细胞的克隆扩增(clonal expansion)尚不清楚。在一项新的研究中,来自美国国家糖尿病、消化与肾疾病研究所和德克萨斯大学西南医学中心的研究人员通过对来自82名患者的患病肝脏样本进行外显子组测序,揭示出肝硬化中的复杂突变景观。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“Somatic Mutations Increase Hepatic Clonal Fitness and Regeneration in Chronic Liver Disease”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.03.026。
进一步的超深度测序鉴定出PKD1、PPARGC1B、KMT2D和ARID1A基因发生频发突变(recurrent mutation)。细胞突变体克隆的数量和大小随着肝脏纤维化阶段和组织损伤的增加而增加。
为了研究突变基因的功能影响,这些研究人员建立了一种合并的体内CRISPR筛选方法。与测序结果一致的是,对147个基因的检测再次表明Pkd1、Kmt2d和Arid1a的缺失促进了克隆扩增。在小鼠中,这些基因的条件性杂合缺失在组织损伤检测中也具有保肝作用。癌变前的体细胞突变通常从癌症的视角来观察,但是他们证实突变能够促进肝脏组织再生,而可能与癌症发生无关。
6.Arch Toxicol:干细胞+3D打印,可用于肝脏移植
doi:10.1007/s00204-018-2280-2
来自爱丁堡大学医学研究委员会(MRC)再生医学中心的科学家结合干细胞技术与3D打印技术,成功培育出了人源3D肝脏组织,并且在小鼠水平显示出治疗的潜力。科学家表示,除了为开发人体肝脏组织植入物方面进行早期的探索,这一研究还可以通过搭建平台来研究人类肝脏疾病以及实验室中的测试药物的药效,从而减少对动物研究的需求。在这项发表在《Archives of Toxicology》杂志上的研究中,科学家们采集了人类胚胎干细胞并诱导形成多能干细胞(已被诱导转变为干细胞的成体细胞),通过定向诱导形成为肝细胞。
科学家们与材料化学家和工程师合作,确定了已经批准用于人体的合适聚合物,以便将它们发展成3-D支架。最好的材料是可生物降解的聚酯聚己内酯,它被制作成微观纤维,纤维网形成一厘米见方,毫米厚的支架。之后,将源自胚胎干细胞的肝细胞(其已在培养物中生长20天)加载到支架上并植入小鼠皮下。
研究结果显示,血管能够在支架上成功生长。此外,作者并且发现小鼠的血液中含有人肝蛋白,表明组织已成功地与循环系统整合,支架未被动物的免疫系统拒绝。进一步,作者在在患有酪氨酸血症的小鼠中测试肝组织支架的效果。酪氨酸血症是一种潜在致命的遗传疾病,其中肝脏中分解氨基酸酪氨酸的酶是有缺陷的,导致有毒代谢产物的积累。
研究结果表明,植入的肝组织能够帮助酪氨酸血症的小鼠分解酪氨酸。与接受空支架的对照组中的小鼠相比,移植有3D打印肝脏组织的小鼠体重减轻,血液中毒素积累较少,并且肝损伤迹象较少。
7.Sci Trans Med:工程化肝脏组织移植后成功扩增
doi:10.1126/scitranslmed.aah5505
许多疾病,包括肝硬化与肝炎等等,都会导致肝脏衰竭的发生。目前美国境内有超过17000名患者受到肝脏衰竭的困扰,焦急地等待肝脏移植。然而,可用的肝脏供体却供小于求。
为了解决供体短缺的问题,研究者们成功地开发出了工程化的肝脏组织。即通过将三种不同类型的细胞包被在可降解的生物活性组织框架中。在小鼠的肝脏损伤疾病模型中,研究者们发现,这一工程化的肝脏在移植进入小鼠腹腔之后,能够扩增50倍左右,并最终能够行使完整的肝脏功能。
这一工程化的肝脏能够帮助数百万饱受慢性肝脏疾病折磨,却苦于没有合适供体的患者带来了福音。相关结果发表在最近一期的《Science Translational Medicine》杂志上。
"这些患者并不急需供体移植,但的确患有肝脏疾病,如果工程化的肝脏能够最终进入临床,那么将会同时为这些患者提供帮助",该文章的作者Kelly Stevens博士说道。
8.Nature:重磅!开发出模拟自然发育的生物工程人肝脏组织
doi:10.1038/nature22796
在一项新的研究中,来自德国、美国和日本的研究人员利用他们开发出的生物工程人肝脏组织发现了之前未知的控制肝脏器官发育过程的分子-细胞交谈网络,这极大地促进利用人多能性干细胞产生健康的可使用的人肝脏组织的努力。他们报道,在临床试验中测试他们的生物工程人肝脏组织之前,仍然需要对它们开展进一步的分子微调。相关研究结果于2017年6月14日在线发表在Nature期刊上,论文标题为“Multilineage communication regulates human liver bud development from pluripotency”。论文通信作者为美国辛辛那提儿童医学中心肠胃病、肝脏与营养科研究员Takanori Takebe博士、德国马克斯-普朗克进化人类学研究所研究员Barbara Treutlein博士和日本横滨市立大学医学研究生院再生医学系研究员Keisuke Sekine博士。

图片来自Cincinnati Children's/Max Planck。
当前治疗晚期肝病的唯一方法是肝脏移植,然而从死亡供者体内获得的肝脏数量是有限的。基于这一点,再生医学的一个主要目标是获得自我组装的人组织,即细胞在准确的时间和空间经历一系列协调的分子事件,从而形成功能性的三维肝芽(liver bud)。
阐明胚胎内胚层发育中的分子-细胞交谈的详细细节和环境对这种技术的治疗潜力是至关重要的。肝脏是在胚胎内胚层中形成的。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


