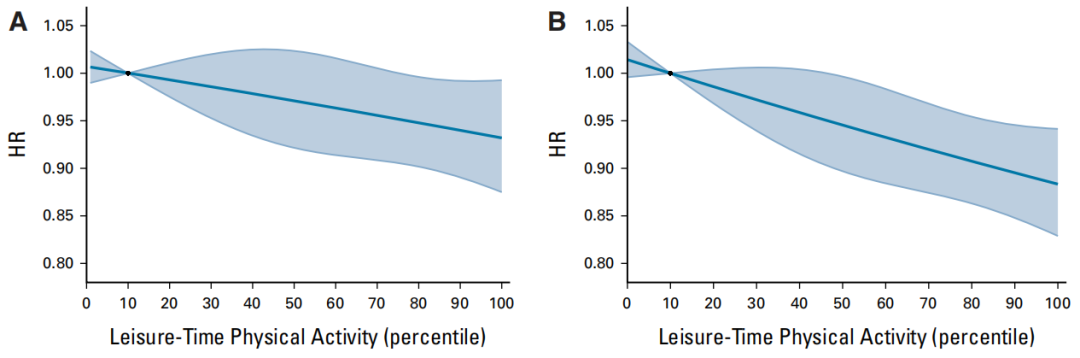
FIDELITY研究中国亚组数据发布:非奈利酮显著降低肾脏复合结局风险43%
非奈利酮是一种新型非甾体高选择性MRA,对MR具有更高的选择性、更强的亲和力,能够高效地阻断醛固酮导致的MR过度激活,从而抑制炎症反应、纤维化,延缓对肾脏结构和功能造成的损伤。
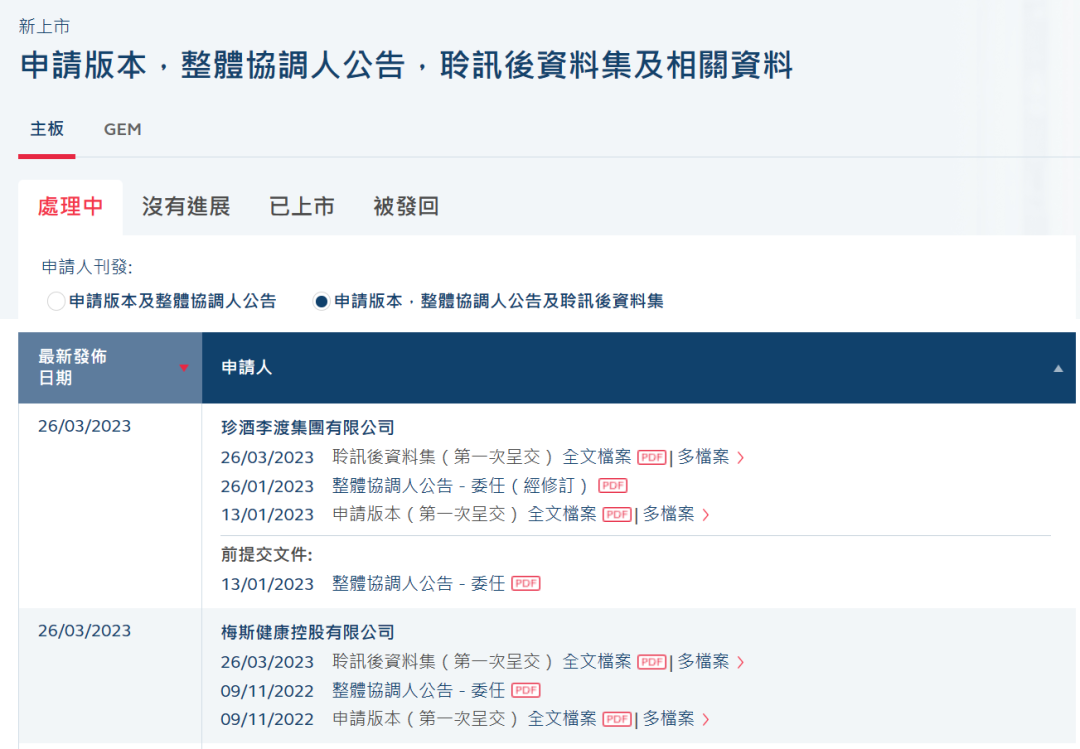
启明、腾讯参投,梅斯健康港交所过聆讯,C轮投后估值43亿元
据港交所官网披露文件显示,2023年3月26日,梅斯健康控股有限公司(以下简称:“梅斯健康”)通过港交所上市聆讯,中金公司及麦格里为联席保荐人。
Nature:揭示与FTLD-TDP相关的淀粉样蛋白是TMEM106B而不是TDP-43
在一项新的研究中,来自美国加州大学洛杉矶分校和梅奥诊所的研究人员在从代表其中四种FTLD-TDP亚型的四名患者的大脑中提取了淀粉样蛋白纤维(amyloid fibril),并通过低温电子显微镜(cry
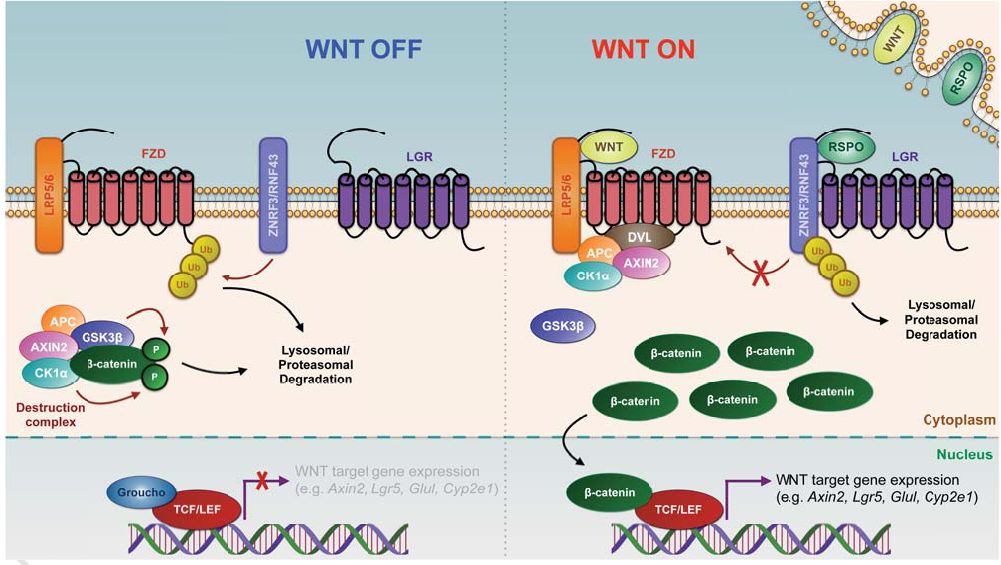
RSPO-LGR4/5-ZNRF3/RNF43模块在肝脏动态平衡、再生和疾病中的作用
Wnt/β-catenin信号在肝脏发育、动态平衡和再生过程中起着重要作用。同样,它的失控干扰了代谢性肝分区,并导致了大量肝肿瘤的发生。
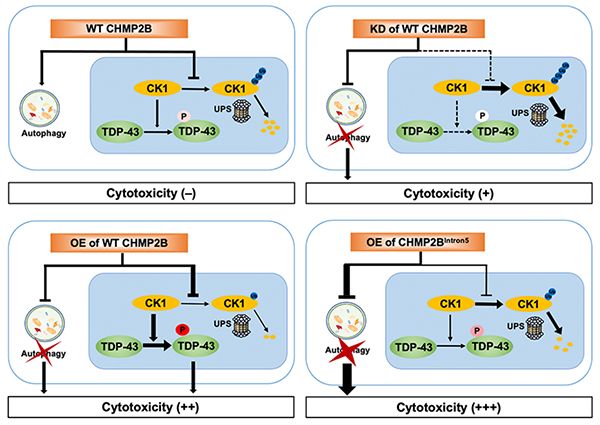
Journal of Cell Biology:研究发现ALS/FTD致病蛋白TDP-43和CHMP2B之间的“分子连接”CK1
含有RNA结合蛋白TAR DNA-binding protein (TDP-43) 的异常蛋白聚集是肌萎缩性侧索硬化症 (amyotrophic lateral sclerosis, ALS) 和额颞叶痴呆 (frontotemporal dementia, FTD) 的关键病理标志物。ESCRT复合物蛋白charged multivesicul
Imfinzi(英飞凡)展现空前生存益处:治疗不可切除性III期肺癌,5年存活率43%!
在中国,Imfinzi于2019年12月获批,标志着不可切除III期非小细胞肺癌迎来了免疫治疗新时代。
ASCO 2021:度伐利尤单抗在III期不可切除肺癌患者中显示出前所未有的生存获益,43%的患者生存达到五年
已报告阳性结果的PACIFIC III期临床试验更新的随访结果显示,阿斯利康的英飞凡(化学名:度伐利尤单抗Durvalumab,商品名:英飞凡Imfinzi)在接受了同步放化疗(CRT)后未出现疾病进展的III期不可切除的非小细胞肺癌(NSCLC)患者中,在五年时显示出了持续且具有临床意义的总生存期(OS)和无疾病进展生存期(PFS)获益。
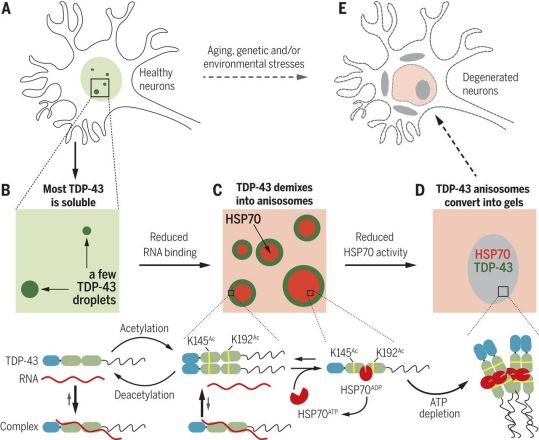
Science:HSP70伴侣蛋白驱动未结合RNA的TDP-43发生相分离形成不均小体
2021年2月10日讯/生物谷BIOON/---RNA结合蛋白TDP-43的聚集是包括肌萎缩侧索硬化症(ALS)和额颞叶痴呆(FTD)在内的几种与年龄相关的神经退行性疾病所共有的病理特征。主要存在于细胞核的TDP-43通常会发生液-液相分离(liquid-liquid phase separation, LLPS),即均相溶液分成两部分,类似于醋中的油滴。细
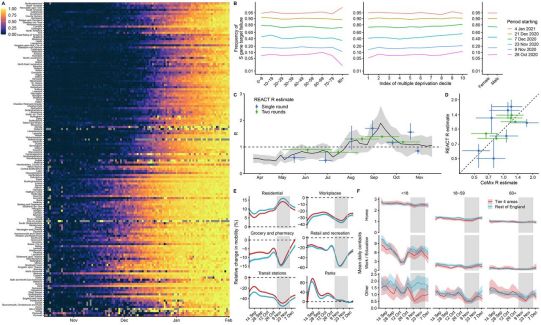
Science:英国新冠病毒变种B.1.1.7的传播性可能比原始病毒高43%至90%
2021年3月8日讯/生物谷BIOON/---在一项新的研究中,来自英国伦敦卫生与热带医学学院等研究机构的研究人员发现,有证据表明英国SARS-CoV-2病毒变种B.1.1.7的传播性可能比原始病毒高43%至90%。相关研究结果近期发表在Science期刊上,论文标题为“Estimated transmissibility and impact of SAR