红云生物新一代EGFR抑制剂H002完成首例非小细胞肺癌患者给药
H002是一款第四代针对晚期非小细胞肺癌的精准治疗候选药物,广谱和选择性抑制多种EGFR突变,特别是含有C797S的三代耐药突变
美国FDA授予叶酸受体α(FolRα)靶向抗体偶联药物STRO-002快速通道资格!
Sutro凭借其专有平台技术,正在与百时美施贵宝、默克等巨头开发新型抗体偶联药物(ADC)。
泰诺麦博TNM002单抗成功获美国FDA批准IND
3月16日,珠海泰诺麦博生物技术有限公司(Trinomab Biotechnology Co., Ltd.,简称“泰诺麦博”及“Trinomab”)宣布,其自主研发的重组抗破伤风毒素单抗药物TNM002的临床试验申请(IND)正式获得美国食品药品管理局(FDA)批准,这是继2020年11月获得澳洲HREC/TGA批准后的又一次临床申请
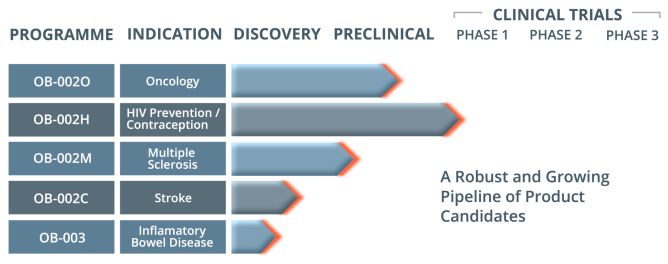
OB-002体外抑制HIV复制效力高于马拉维若(maraviroc)80倍
2019年07月25日/生物谷BIOON/--Orion Biotechnology Canada Ltd.是一家私营制药公司,利用先进的受体药理学开发治疗严重慢性病和危及生命疾病的新疗法。近日,该公司公布了其先导化合物——趋化因子类似物OB-002的体外药效评估研究的数据。结果显示,OB-002与其他在研的用于HIV预防和癌症适应症的CCR5拮抗剂更有效。本月初,在多发性硬化症临床前模型中,OB
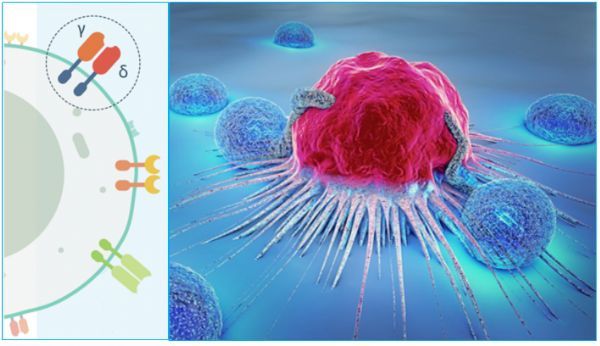
TCB公司启动新型T细胞疗法TCB002治疗急性髓性白血病(AML) I期临床
2019年04月28日/生物谷BIOON/--TC BioPharm(TCB)是一家异基因CAR-T免疫肿瘤学产品的开发商,以及γδT(GDT)细胞疗法领域的领导者。近日,该公司宣布已启动TCB002治疗急性髓性白血病(AML)的一项I期临床研究(NCT03790072)。TCB002是一种由已激活的和扩增的GDT细胞组成的异基因细胞疗法。该项研究于2018年底获得监管批准,患者招募于2019年1
Sutro新型抗体药物偶联物STRO-002进入卵巢癌I期临床开发
2019年03月18日/生物谷BIOON/--Sutro Biopharma是一家临床阶段的美国生物制药公司,致力于通过精准蛋白质工程和合理设计开发下一代免疫肿瘤学疗法。近日,该公司宣布,评估STRO-002治疗卵巢和子宫内膜癌患者的I期临床研究已进行了首例患者给药。STRO-002是一种抗叶酸受体α(FolRα)抗体药物偶联物(ADC),是来自Sutro公司专有和集成的无细胞蛋白质合成和位点特异
美国FDA授予口服JAK/SYK双效抑制剂ASN002治疗特应性皮炎的快速通道资格
2018年12月12日讯 /生物谷BIOON/ --Asana BioSciences是一家临床阶段的生物制药公司,专注于发现和开发免疫学/炎症和肿瘤学领域的新型靶向疗法。近日,该公司宣布,美国食品和药物管理局(FDA)已授予ASN002治疗中度至重度特应性皮炎的快速通道资格。ASN002是一种实验性口服、Janus激酶(JAK)和脾酪氨酸激酶(SYK)双效抑制剂。快速通道项目旨在加速针对严重疾病
Zynerba宣布骨关节炎药物ZYN002 II期临床试验结果:未达主要终点
2017年8月22日讯/生物谷BIOON/——Zynerba制药(NASDAQ:ZYNE)是一家致力于研发大麻素经皮药物生产的专业制药公司,今天公布了其II期 STOP(用于治疗由骨关节炎引起的膝盖疼痛的合成透皮大麻二酚)临床试验评估ZYN002(大麻二酚凝胶)的结果。该研究没有达到其在任意剂量下第12周24小时平均严重疼痛评分的每周平均值降低(相比基线)的主要终点。但是,对于次要终点则得到了具有
ADMA生物医药公司开始RL-002 III期临床研究
ADMA生物医药公司开始进行RL-002 III期临床研究,这是一种治疗原发性免疫缺陷症(PIDD)患者的药物。 RI-002是一种多克隆注射性免疫球蛋白,含有天然多克隆抗体。 研究将招募60到70名PIDD患者,将对他们进行为期12个月的治疗以及90天的后续跟踪研究,目的是评估RI-002的安全性和药效。
ADMA生物医药公司开始RL-002 III期临床研究
ADMA生物医药公司开始进行RL-002 III期临床研究,这是一种治疗原发性免疫缺陷症(PIDD)患者的药物。 RI-002是一种多克隆注射性免疫球蛋白,含有天然多克隆抗体。 研究将招募60到70名PIDD患者,将对他们进行为期12个月的治疗以及90天的后续跟踪研究,目的是评估RI-002的安全性和药效。