天境生物与ABL Bio宣布TJ-L14B美国1期临床完成首例患者给药
4月6日,天境生物与韩国ABL Bio共同宣布,双方合作开发的双特异性抗体TJ-L14B/ABL503的美国1期临床研究已完成首例患者给药。该研究为一项开放标签、多中心的剂量爬坡和剂量扩展试验(NCT04762641),旨在评估TJ-L14B/ABL503用于治疗局部晚期或转移性实体瘤的安全性、耐受性、药代动力学、药效学、抗肿瘤活性、
首个胆管癌靶向药!强效FGFR激酶抑制剂Pemazyre(pemigatinib)欧盟获批,信达生物引进中国!
Pemazyre是美国、日本、欧盟第一个也是唯一一个针对胆管癌的靶向疗法,通过阻断肿瘤细胞中的FGFR2来阻止肿瘤细胞的生长和扩散。
新时代下生物药如何创新采购更加利国利民?
在两会期间,国家领导人指出,要继续加大医保改革力度,常态化制度化开展药品集中带量采购,健全重特大疾病医疗保险和救助制度,深化医保基金监管制度改革,守好人民群众的“保命钱”、“救命钱”。近年来,国家在保证药品质量一致性的前提下,对临床用量大、采购金额高、竞争充分的化学药品组织药品集中采购,在降低药品价格、减轻群众看病就医负担、提高行业集
首个胆管癌靶向药!强效FGFR激酶抑制剂Pemazyre(pemigatinib)获日本批准,信达生物引进中国!
信达生物拥有大中华区权利,Pemazyre是第一个获批治疗胆管癌的靶向药物,通过阻断肿瘤细胞中的FGFR2来阻止肿瘤细胞的生长和扩散
罗氏Actemra/RoActemra(托珠单抗)获批:首个治疗系统性硬化症相关间质性肺病(SSc-ILD)的生物药!
治疗SSc-ILD方面,勃林格殷格翰口服酪氨酸激酶抑制剂Ofev(尼达尼布)是首个获批的药物。
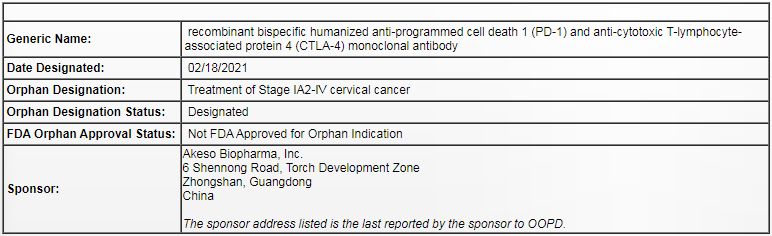
康方生物PD-1/CTLA-4双抗治疗宫颈癌获美国FDA孤儿药认定
2月23日,康方生物(9926.HK)宣布, 旗下PD-1/CTLA-4双特异性抗体Cadonilimab获得美国食品药品监督管理局(FDA)授予的孤儿药资格认定,用于治疗宫颈癌(除极早期IA1期之外)。这是继2020年Cadonilimab治疗经标准治疗后的复发或转移性宫颈癌获得FDA授予快速审批通道资格(FTD)和国家药品监督管理
安进美罗华生物类似药RIABNI获FDA批准上市
近日,安进公司向外宣布,美国食品药品管理局(FDA)已批准美罗华?(Rituxan ,rituximab,利妥昔单抗)生物类似药RIABNI (rituximab-arrx)在美上市,用于治疗成人非霍奇金淋巴瘤(NHL),慢性淋巴细胞性白血病(CLL),肉芽肿性多血管炎(GPA)(韦格纳氏肉芽肿病)和显微镜下多血管炎(MPA)。RIABNI将于2021年1月
信达生物宣布IBI310联合达伯舒III期临床研究完成首例患者给药
信达生物宣布:IBI310(抗CTLA-4单抗)联合PD-1抑制剂达伯舒?(信迪利单抗注射液)用于治疗一线晚期肝细胞癌的一项随机、开放、对照的多中心III期关键临床研究(NCT04720716)已完成首例患者入组及给药。近年来,免疫检查点抑制剂显示出了可接受的安全性和令人鼓舞的有效性,为肝癌患者带来了新的治疗希望。本研究是一项在中国开