CDE发布中国新药注册临床试验现状年度报告
国家药监局药审中心发布《中国新药注册临床试验现状年度报告(2020年)》(以下简称《报告》),这是首次对中国新药注册临床试验现状进行全面汇总分析的一份报告。该《报告》主要根据药物临床试验登记与信息公示平台2020年度登记的药物临床试验信息,从申办者类型、药物类型、试验品种、适应症、试验分期、特殊人群试验、临床试验的组长单位、启动耗时和
如何撰写符合注册要求的CAR-T细胞治疗产品临床风险管理计划
近日,国家药品监督管理局药品审评中心官网发布《嵌合抗原受体T细胞(CAR-T)产品申报上市临床风险管理计划技术指导原则(征求意见稿)》,征求意见时限为自发布之日起1个月,此指导原则适用于CAR-T细胞治疗产品,实施后有助于降低和有效控制CAR-T类产品上市后的安全性风险,以最大限度保护患者。细胞治疗产品的良好疗效,将引领生物医药的第三次产业革命。目前,欧美监
山东新冠抗体检测试剂盒取得医疗器械注册证
近日,山东省生物诊断技术创新中心的科技创新成果——新型冠状病毒(2019-nCoV)IgM/IgG抗体检测试剂盒(胶体金法)取得国家药品监督管理局颁发的医疗器械注册证。作为山东省首批试点的五家技术创新中心之一,山东省生物诊断技术创新中心此次获批的新型冠状病毒(2019-nCoV)IgM/IgG抗体检测试剂盒(胶体金法),由
基石药业将在ESMO年会上口头报告艾伏尼布的中国注册桥接研究临床数据
8月12日,基石药业(香港联交所代码:2616)宣布,公司将在2021年欧洲肿瘤内科学会(ESMO)年会上公布同类首创药物艾伏尼布中国注册桥接研究CS3010-101的临床数据。
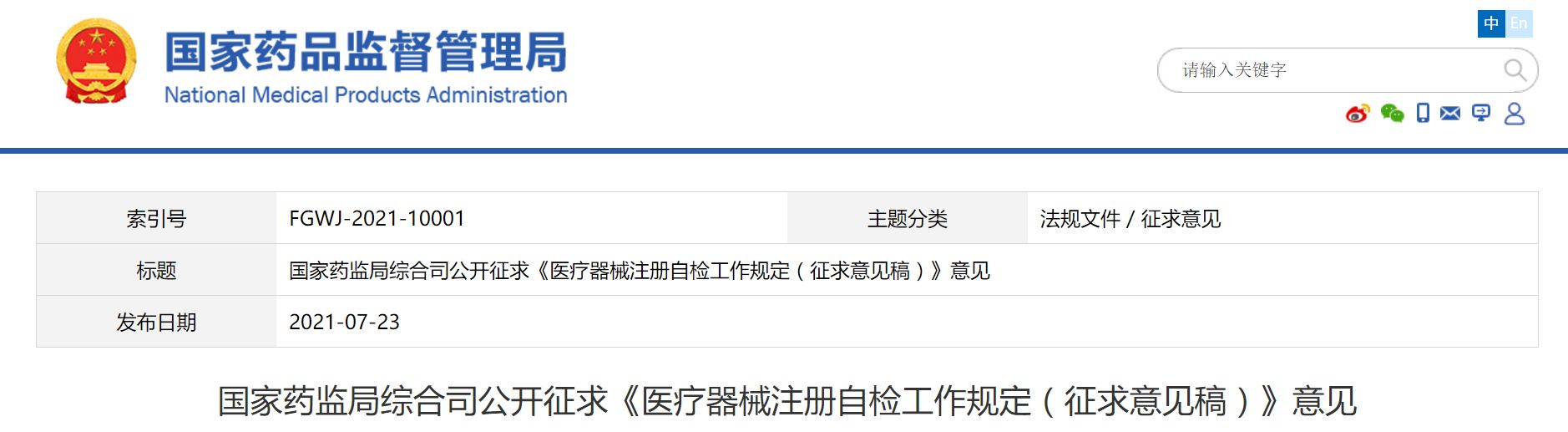
国家药监局综合司公开征求医疗器械注册自检工作规定的意见
7月23日,为做好《医疗器械监督管理条例》配套文件制修订工作,国家药监局在此前征求意见的基础上,进一步修改完善了《医疗器械注册自检工作规定(征求意见稿)》(见附件),现再次向社会公开征求意见。请将意见反馈至电子邮箱:ylqxzc@sina.cn。请在邮件主题处注明“自检要求反馈意见”。反馈意见截止时间为2021年7月31日。原文如下:医疗器械注册自检工作规定
【倒计时6天】生物制品注册变更、工艺验证与现场核查(附知名企业名单)
截至昨日,药研论坛共收到包括苏州礼来、复宏汉霖、康宁杰瑞、上海京新、鲁南制药、苏州鲲鹏、西安杨森、上海西比曼、苏州宜明、苏州怡道等一大批国内知名生物药企业报名信息。目前所剩名额不多,有需要的企业请抓紧报名!!!主 办 | 药研时 间 | 2021年7月3~4日地 点 | 苏州维也纳国际酒店支持媒体:
东阳光子公司收到草酸艾司西酞普兰片药品注册证书
4月20日,东阳光发布公告称,控股子公司东莞市阳之康医药有限责任公司于近日收到国家药监局核准签发的草酸艾司西酞普兰片《药品注册证书》。艾司西酞普兰用于治疗抑郁症,是二环氢化酞类衍生物西酞普兰的单右旋光学异构体。艾司西酞普兰抗抑郁病作用的机制可能是抑制中枢神经系统神经元对5-羟色胺(5-HT)的再摄取,从而与增强中枢5-羟色胺能神经的功能有关。目前,艾司西酞普
国家药监局发布基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查等5项注册技术审查指导原则的通告
近日,为加强医疗器械产品注册工作的监督和指导,国家药监局官网发布基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查等5项注册技术审查指导原则的通告。原文如下:为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查指导原则》《实时荧光PCR