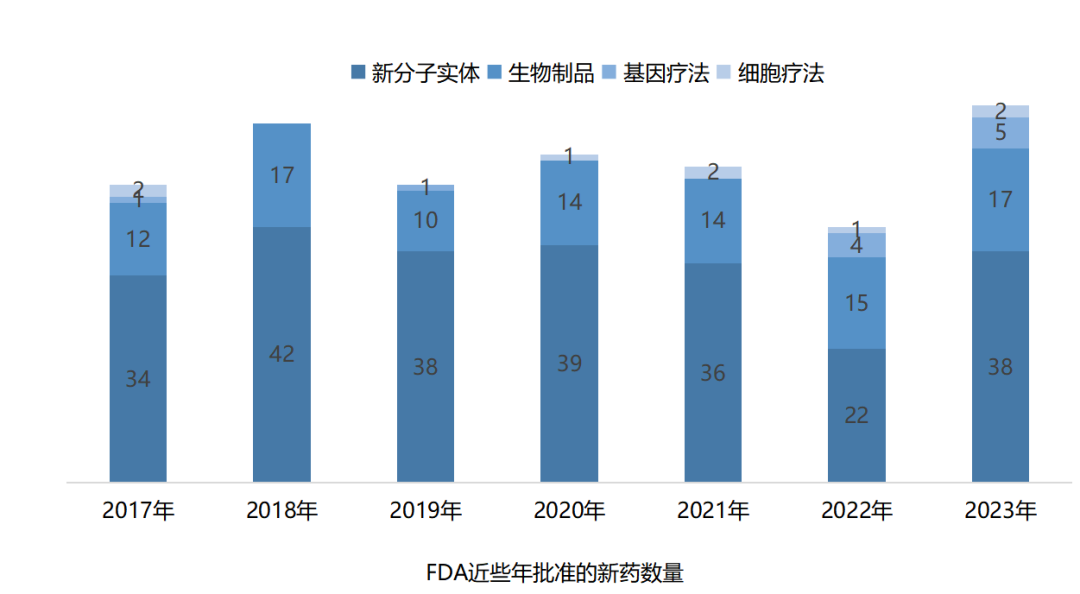
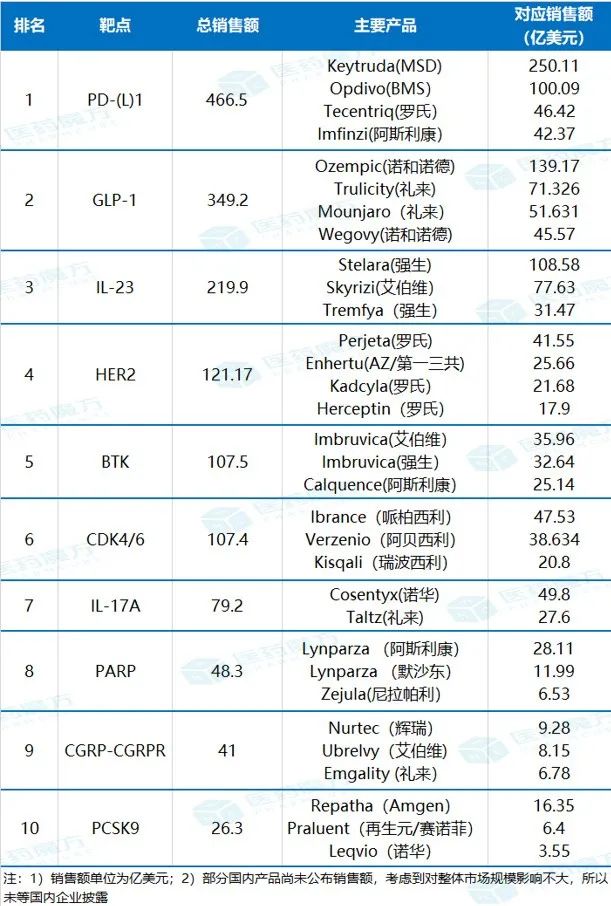
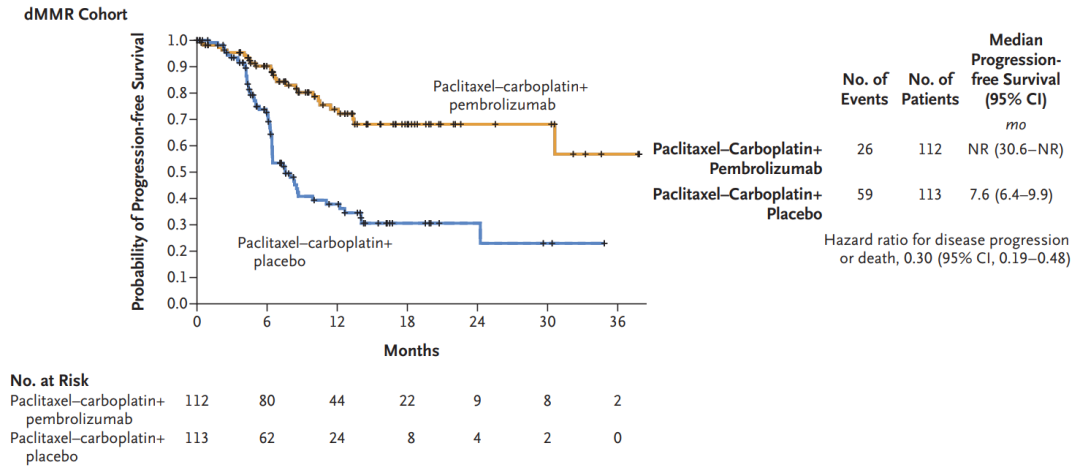
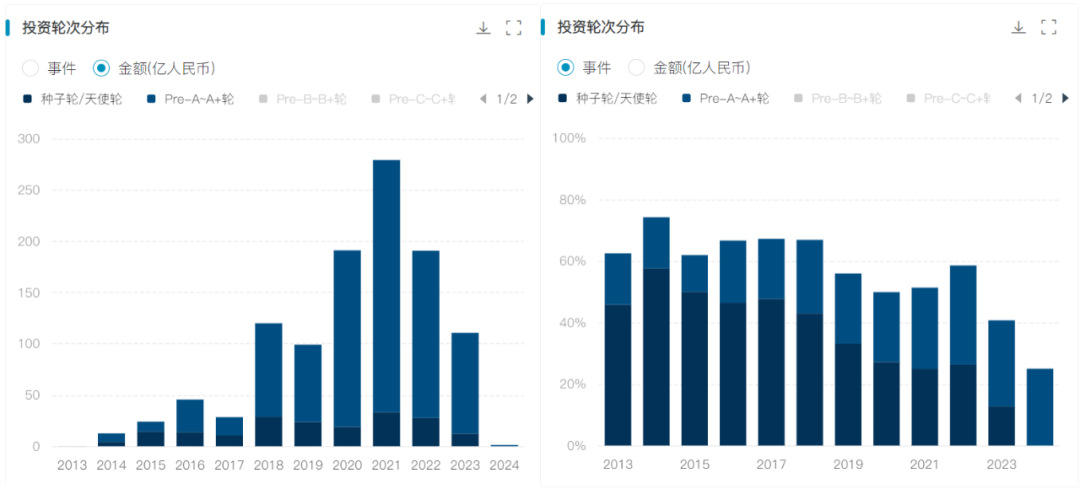
世界首例猪肝脏人体实验,经过69处基因编辑,未发生排异反应,已申请临床试验
研究团队使用eGenesis公司开发的基因编辑猪肝脏,将其连接到OrganOx公司的体外肝脏交叉循环(ELC)设备,让该捐赠者的血液通过基因编辑猪肝脏进行循环。
2024-01-22
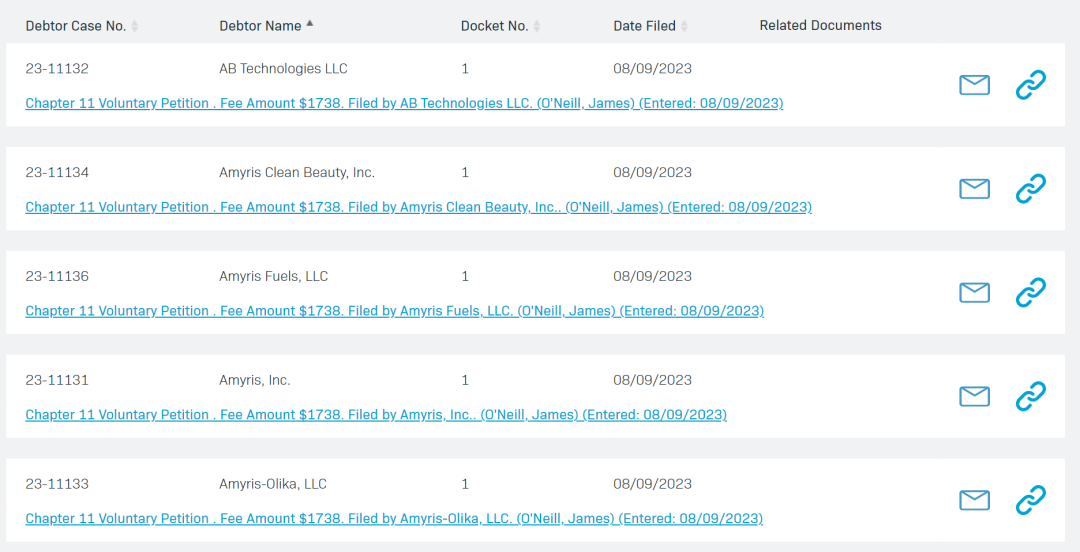
Amyris在美国申请破产,即将推进财务和运营重组
与此同时,为了推进公司的重组目标并实现资产价值最大化,Amyris 计划退出其消费品牌并开始营销销售,以期让这些品牌在新的所有权下,继续利用 Amyris 的科学和技术。
2023-08-13
Oncogene:新药plixorafenib或有望治疗人类皮肤鳞状细胞癌
来自图尔库大学等机构的科学家们通过研究发现,一种用于治疗黑色素瘤和肺癌的新型药物plixorafenib或能阻断皮肤鳞状细胞癌的进展。
2023-11-28
重大疾病新药创制全国重点实验室面向全球公开招聘
重大疾病新药靶发现及新药创制全国重点实验室已被江西省人社厅授予自然科学研究系列、实验系列、工程系列生物工程专业、工程系列制药工程专业中、高级职称自主评审权。
2024-03-20