巨细胞病毒(CMV)创新药!美国FDA批准武田Livtencity:首个用于移植受者治疗难治性CMV感染的药物!
Livtencity是一种新分子实体,疗效优于常规疗法且安全性更高,将重新定义移植受者CMV感染/疾病治疗。
首个腱鞘巨细胞瘤药物!第一三共新型口服CSF1R抑制剂pexidartinib遭欧盟CHMP否决!
在美国,pexidartinib正在接受FDA优先审查,该药有潜力成为第一个治疗存在严重的发病率或功能限制且不适合手术改善的有症状腱鞘巨细胞瘤(TGCT)的药物。
首款腱鞘巨细胞瘤药物批准上市 且看靶点CSF1R竞争格局
2019年8月2日获美国食品药品监督管理局(FDA)批准Pexidartinib上市,用于治疗功能受限且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者。Pexidartinib是该疾病的首款获批药物。Pexidartinib是一种集落刺激因子1受体(CSF1R)抑制剂,开发该靶点的领头企业有辉瑞、诺华等,代表药物有苹果酸舒尼替尼等,CSF1R药物2018年的销售额接近两亿美元.
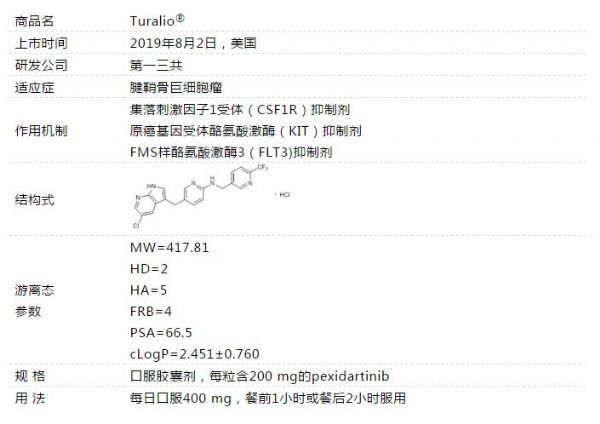
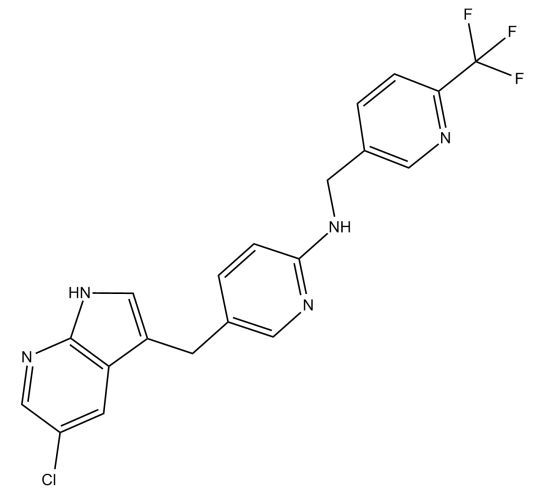
首个罕见关节肿瘤药物!美国FDA批准第一三共新型CSF1R抑制剂Turalio,治疗腱鞘巨细胞瘤!
2019年08月03日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)靶向抗癌药Turalio(pexidartinib胶囊剂)近日喜获美国食品和药物管理局(FDA)批准,用于存在严重的发病率或功能限制且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者的治疗。TGCT是一种罕见的肿瘤,影响滑膜和肌腱鞘,该肿瘤很少有恶性的,但会导致滑膜和肌腱鞘增厚或过度生长,对周
首个腱鞘巨细胞瘤药物!第一三共新型口服CSF1R抑制剂pexidartinib在美欧进入审查
2019年4月08日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)近日宣布,欧洲药品管理局(EMA)已受理pexidartinib的上市许可申请(MAA)。该MAA申请批准pexidartinib用于存在严重的发病率或功能限制且不适合手术改善的有症状腱鞘巨细胞瘤(TGCT)成人患者的治疗。之前,EMA已授予pexidartinib治疗TGCT的孤儿药资格。在美国,F
首个腱鞘巨细胞瘤药物!第一三共新型口服CSF1R抑制剂pexidartinib获美国FDA优先审查
2019年2月14日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)近日宣布,美国食品和药物管理局(FDA)已受理pexidartinib的新药申请(NDA)并授予了优先审查资格(PRD),该NDA申请批准pexidartinib用于存在严重的发病率或功能限制且不适合手术改善的有症状腱鞘巨细胞瘤(TGCT)成人患者的治疗。FDA已指定处方药用户收费法(PDUFA)目标
罗氏抗炎药RoACtemra(托珠单抗)获英国NICE批准治疗巨细胞动脉炎(GCA)
2018年03月09日讯 /生物谷BIOON/ --瑞士制药巨头罗氏(Roche)抗炎药RoActemra(tocilizumab,托珠单抗)近日在英国监管方面传来喜讯。英国国家卫生与临床优化研究所(NICE)已发布指南,支持该药用于英国国家服务系统(NHS),用于巨细胞动脉炎(GCA)患者的治疗。而在去年发布的草案指南中,RoActemra曾遭到NICE拒绝,原因是评估委员会认为该药在患者需要接
FDA授予抗巨细胞病毒感染新药Maribavir突破性药物资格
英国制药商夏尔(Shire)近日宣布,美国食品和药物管理局(FDA)已授予实验性抗病毒药物maribavir(SHP620)治疗移植患者巨细胞病毒(CMV)感染的突破性药物资格(BTD)。maribavir属于名为苯并咪唑核苷的一类药物,该药是一种口服可生物利用的抗病毒疗法,目前正处于III期临床开发,评估在伴有CMV感染且对当前标准的CMV治疗药物耐药或难治的造血干细胞移植或实体器官移植受者中的
默沙东首款巨细胞病毒感染患者药物获批!
2017年11月13日讯 /生物谷BIOON/ --11月9日,默沙东(MSD)宣布,FDA批准了PREVYMI(letermovir)口服片剂和静脉注射液,用于治疗接受异基因造血干细胞移植(HSCT)后巨细胞病毒(CMV)血清呈阳性的成人患者。该药物可预防CMV感染和相关疾病。值得一提的是,letermovir是15年来在美国批准的第一种CMV感染新药。CMV是一种常见的病毒,所有年龄的患者均有
FDA批准史上首个巨细胞动脉炎药物
今天,罗氏(Roche)旗下基因泰克(Genentech)宣布,美国FDA扩大批准了Actemra(tocilizumab单抗)的适应症,用于皮下注射治疗巨细胞动脉炎成年患者。这一新的适应症成为首例经FDA批准的特别针对这种类型血管炎的治疗方案。巨细胞动脉炎是一种血管炎,这是一大类因为血管炎症而导致的疾病。由于这种炎症反应,导致动脉变窄或变得不规则,妨碍足够的血液流动。在巨细胞动脉炎中,受影响的大