Opdivo组合疗法获FDA优先审评
今日,百时美施贵宝(BMS)和Exelixis宣布,美国FDA已分别接受为Opdivo(nivolumab)联合Cabometyx(cabozantinib)治疗晚期肾细胞癌(RCC)患者的补充生物制品许可申请(sBLA)和补充新药申请(sNDA)。FDA同时授予这两个申请优先审评资格,预计在2021年2月20日前做出回复。全球约有71,000例
药明巨诺通过港交所聆讯 relma-cel纳入优先审评和突破性治疗品种
10月18日,港交所网站公示信息显示,药明巨诺(开曼)有限公司(下称“药明巨诺(开曼)”)IPO申请已通过港交所聆讯。药明巨诺(开曼)致力于细胞免疫疗法的开发,于今年8月向港交所提交上市申请。该公司的抗CD19 CAR-T疗法relmacabtagene autoleucel(下称“relma-cel”)的新药上市申请已在今年9月被中
泽璟制药肝癌1类新药上市申请拟纳入优先审评
10月12日,中国国家药监局药品审评中心(CDE)网站最新公示,泽璟制药1类新药甲苯磺酸多纳非尼片上市申请拟纳入优先审评,本次申请的拟定适应症为——用于治疗晚期(无法手术或转移性)肝细胞癌。这不仅意味着多纳非尼有望在中国加速获批,也意味着泽璟制药将有望迎来首款获批上市的药品。多纳非尼是泽璟制药开发的口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,属于1类新药。临
5款新药拟纳入优先审评 来自贝达药业、阿斯利康、拜耳等
10月12日,中国国家药监局药品审评中心(CDE)网站公示,5款新药上市申请拟纳入优先审评(详见下表)。这些产品分别是贝达药业1类新药埃克替尼,阿斯利康(AstraZeneca)EGFR-TKI奥希替尼,泽璟制药肝癌新药多纳非尼,拜耳(Bayer)抗血栓产品利伐沙班,赛诺菲(Sanofi)"双靶点"抗体度普利尤单抗(dupilumab)。拟纳入优
第四季度FDA新药审评:这些看点值得关注
治疗埃博拉病毒感染的鸡尾酒疗法,治疗精神分裂症与双相障碍症的ALKS-3831,有望成为第4个获批上市的CAR-T疗法……有哪些新药审评亮点值得关注?除了全力以赴应对COVID-19大流行之外,FDA的正常工作也按部就班进行。今年第四季度,值得关注的在审药物,包括用于淋巴瘤的一种细胞疗法、一种治疗精神分裂症的复方药物、一种新的贫血药,以及一种治疗
“first-in-class“疗法获FDA优先审评资格 治疗致命A型MoCD
BridgeBio Pharma和其子公司Origin Biosciences宣布,美国FDA已经接受了为fosdenopterin(原名BBP-870/ORGN001)递交的新药申请(NDA)并授予其优先审评资格。Fosdenopterin是一种环吡喃单磷酸(cyclic pyranopterin monophosphate,cPMP)底物替代疗法,用于治
百济神州「迪妥昔单抗」和「泽布替尼」拟纳入优先审评
9月29日,中国国家药监局(NMPA)药品审评中心(CDE)公示,百济神州2款新药拟纳入优先审评。其中一款为迪妥昔单抗注射液,正在开发用于治疗多种神经母细胞瘤。根据公开信息,这是今年初百济神州从EUSA Pharma引进的单克隆抗体QARZIBA(dinutuximab beta),它可以与神经母细胞瘤细胞过度表达的特定靶标GD2.iii结合。另一款为BTK
爱美津制药罕见病用药拟纳入优先审评
9月14日,中国国家药监局药品审评中心(CDE)网站最新显示,由爱美津制药按4类仿制药提交的麦格司他胶囊上市申请拟纳入优先审评,拟定适应症(或功能主治)为:用于成人及儿童C型尼曼匹克病患者的进行性神经症状的治疗。麦格司他(miglustat)是一种葡糖神经酰胺合成酶抑制剂,它能够降低葡萄糖脑苷脂水平,从而缓解患者症状。葡糖神经酰胺合成酶是大多数鞘糖脂类合成的
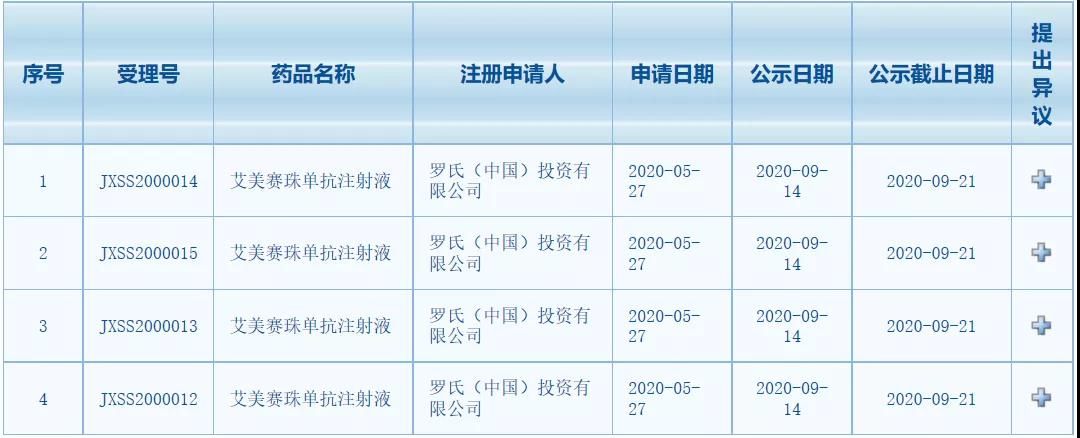
罗氏重磅血友病新药4项上市申请拟纳入优先审评
中国国家药监局药品审评中心(CDE)网站最新公示显示,罗氏(Roche)提交的艾美赛珠单抗注射液(emicizumab,Hemlibra)4项新药上市申请(NDA)拟纳入优先审评。这是一款双特异性抗体,曾被美国FDA授予突破性疗法认定和优先审评资格。在中国,艾美赛珠单抗是临床急需境外新药品种之一,已于2018年通过优先审评审批程序获批上市,治疗A型血友病。根