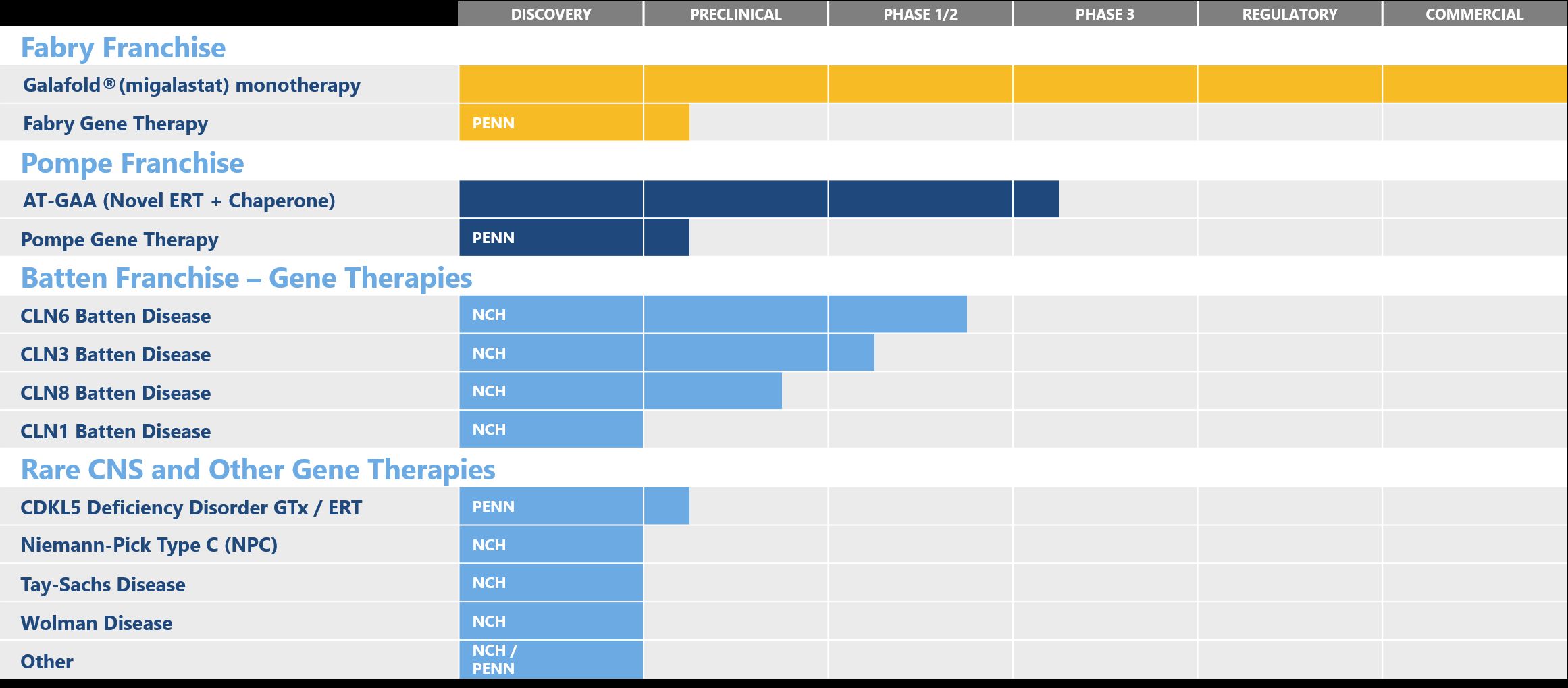
Amicus公司庞贝氏症二代疗法AT-GAA斩获美国FDA突破性药物资格
2019年02月28日/生物谷BIOON/--Amicus Therapeutics是一家专注于发现、开发和商业化新型高质量药物用于治疗罕见代谢性疾病的生物技术公司。近日,该公司宣布,美国食品和药物管理局(FDA)已授予AT-GAA治疗晚发型庞贝氏症(late onset Pompe disease,LOPD)的突破性药物资格(BTD)。值得一提的是,AT-GAA是有史以来第一个获得BTD的庞贝氏
Science丨迭代的第三代CAR-T表现会更优秀吗?最新研究揭示二代、三代CAR-T作用机制
在过去的十年中,新型肿瘤免疫疗法取得了长足的进步,这种疗法激活了患者自身的免疫系统以靶向癌细胞。CAR-T细胞疗法在某些癌症中显示出显著的活性,并且两种CAR-T疗法,Kymriah和Yescarta已获得FDA批准用于治疗急性淋巴细胞白血病和大B细胞淋巴瘤。然而,尽管CAR-T细胞疗法取得了进展,但科学家尚未完全确定CAR -T细胞在结构上如何发挥作用。近日,来自美国墨菲特癌症中心(Moffit
拜耳获得全球首个TRK抑制剂Vitrakvi和二代药物BAY2731954全球独家权利
2019年02月16日讯 /生物谷BIOON/ --德国制药巨头拜耳(Bayer)已根据与Loxo Oncolog公司合作协议中的控制权变更条款行使其选择权,以获得2款抗癌药Vitrakvi(larotrectinib)和BAY2731954(LOXO-195)全球开发和商业化的独家许可权,包括美国市场。这2款药物正在全球范围内开发,用于治疗肿瘤中携带NTRK基因融合的晚期实体瘤儿童和成人患者。此
FDA批准Andexxa第二代制造工艺的预先批准补充
日前,Portola Pharmaceuticals宣布,美国FDA批准了关于大规模第二代Andexxa [凝血因子Xa(重组)]的公司预先批准补充(PAS),允许其在美国进行广泛的商业发布。扩大患者对Andexxa的使用,Andexxa是首个也是唯一一款针对凝血因子Xa抑制剂(利伐沙班或阿哌沙班)的解毒剂;2019年1月开始全面商业发布 。Andexxa获得美国孤儿药和FDA突破治疗
二代基因测序对癌症治疗究竟是奢侈品,还是标配?
Bryce Olson是英特尔的一名员工,几年前,非常突然的,Bryce被诊断出了IV期前列腺癌,肿瘤的侵袭性很强,而且已经发生了多处转移。一开始,Bryce尝试了手术、化疗和放疗,然而这些传统疗法都不能阻止肿瘤的发展。Bryce想,按照这样发展,自己大概看不到女儿小学毕业了。Bryce Olson讲述自己的抗癌经历传统疗法的大门虽然被封了,好在,二代基因测序(Next Generat
吉利德吉二代Harvoni(夏帆宁)获中国批准,治疗1-6型丙肝
2018年12月10日讯 /生物谷BIOON/ --美国制药巨头吉利德(Gilead)近日宣布,中国国家药品监督管理局(NMPA)已批准丙肝复方药Harvoni(夏帆宁,ledipasvir/sofosbuvir,来迪派韦90mg/索磷布韦400mg),用于治疗1-6型慢性丙型肝炎病毒(HCV)感染的成人及12-18岁青少年患者。丙型肝炎是一项重大的公共卫生挑战。据估计,在中国,有近1000万人患
安斯泰来二代FLT3抑制剂Xospata获美国FDA批准,治疗复发性/难治性AML
2018年11月29日/生物谷BIOON/--日本药企安斯泰来(Astellas)近日宣布,美国食品和药物管理局(FDA)已批准Xospata(gilteritinib),用于经FDA批准的一种检测方法证实存在FLT3突变的复发性或难治性(药物难治)急性髓性白血病(AML)成人患者的治疗。Xospata是一种口服疗法,此次批准,使该药成为FDA批准用于复发性或难治性AML患者群体的首个也是唯一一个
SureDesign 二代测序捕获panel设计全攻略
ALK阳性肺癌二线新药!武田新一代靶向抗癌药Alunbrig获欧盟批准
2018年11月28日/生物谷BIOON/--日本制药巨头武田(Takeda)近日宣布,欧盟委员会(EC)已批准Alunbrig(brigatinib)作为一种单药疗法,用于既往接受Xalkori(crizotinib,克唑替尼)治疗病情进展的间变性淋巴瘤激酶阳性(ALK+)晚期非小细胞肺癌(NSCLC)成人患者的治疗。Alunbrig的获批,是基于一项全球性、2组、开放标签、多中心II期临床研究
Dova公司第二代TPO-RA药物Doptelet治疗ITP新适应症在美进入审查
2018年11月09日讯 /生物谷BIOON/ --Dova制药公司近日宣布,美国食品和药物管理局(FDA)已受理Doptelet(avatrombopag)一份补充新药申请(sNDA),用于对先前疗法反应不足的慢性免疫性血小板减少症(ITP)患者的治疗。FDA已指定该sNDA的处方药用户收费法(PDUFA)目标日期为2019年6月30日。ITP是一种以血小板减少为特征的自身免疫性出血性疾病,例如