Autophagy:揭示巨噬细胞调控糖代谢和清除细菌的机制
来源:分子细胞卓越中心 2021-10-19 18:41
巨噬细胞通过模式识别受体等机制,识别细菌的各种组分,能启动炎症反应、吞噬细菌或者导致感染巨噬细胞发生焦亡等,在宿主防御细菌感染中发挥重要作用。在感染细菌或被LPS激活后,巨噬细胞发生显着的葡萄糖代谢变化,包括有氧糖酵解、磷酸戊糖途径、三羧酸循环。葡萄糖代谢不仅与巨噬细胞介导的炎症反应密切相关,也与细胞自噬或吞噬功能相关。葡
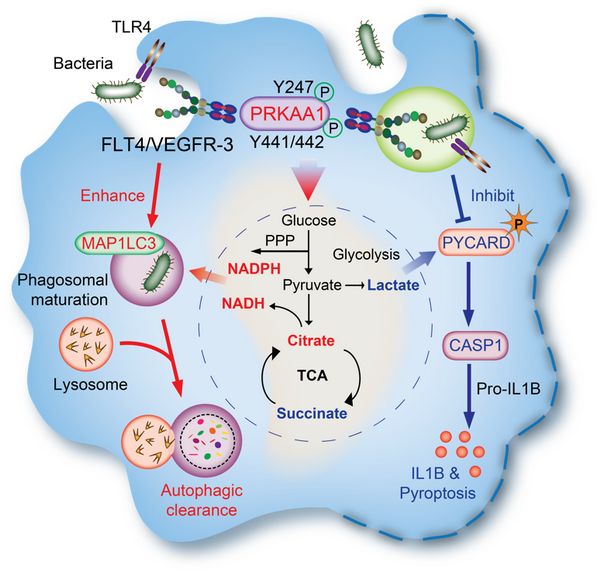
巨噬细胞通过模式识别受体等机制,识别细菌的各种组分,能启动炎症反应、吞噬细菌或者导致感染巨噬细胞发生焦亡等,在宿主防御细菌感染中发挥重要作用。在感染细菌或被LPS激活后,巨噬细胞发生显着的葡萄糖代谢变化,包括有氧糖酵解、磷酸戊糖途径、三羧酸循环。葡萄糖代谢不仅与巨噬细胞介导的炎症反应密切相关,也与细胞自噬或吞噬功能相关。葡萄糖能量代谢不足会导致细胞ATP水平下降,激活能量传感器AMPK相关的信号通路,促进自噬。那么在应对细菌感染时,巨噬细胞通过哪些关键分子及信号通路,能将炎症反应、细胞焦亡、吞噬清除细菌与葡萄糖代谢紧密联系整合在一起,从而影响宿主抗细菌感染的进程呢?
近日,中国科学院分子细胞科学卓越创新中心王红艳团队与上海大学及苏州大学研究团队合作,以FLT4/VEGFR3 activates AMPK to coordinate glycometabolic reprogramming with autophagy and inflammasome activation for bacterial elimination为题在Autophagy上发表研究成果。该研究揭示了巨噬细胞表面的酪氨酸激酶受体VEGFR3与AMPK形成的信号轴能整合糖代谢、炎症小体活化、细胞焦亡和吞噬清除细菌的功能。
研究人员前期的工作发现细菌感染的巨噬细胞诱导性上调表面受体VEGFR3(血管内皮生长因子受体-3,又称FLT4)和相应配体VEGFC的表达。在该研究中,通过分析败血症小鼠模型肝脏组织中葡萄糖代谢谱,发现与野生小鼠相比,VEGFR3缺陷小鼠明显降低磷酸戊糖途径、NAD(P)H含量、三羧酸循环中间产物柠檬酸,这些代谢产物能参与巨噬细胞清除细菌的功能;VEGFR3缺陷小鼠也同时上调了琥珀酸和乳酸等促炎代谢物在肝脏组织中的水平。巨噬细胞通过VEGFR3增加吞噬、ROS产生和自噬体的成熟,促进细菌清除;同时也能抑制caspase-1介导的炎症小体活化和巨噬细胞的焦亡;这些功能伴随着上述糖代谢产物的相应变化。在分子机制上,VEGFR3结合并促进AMPKα亚基中Y247和Y441/442的磷酸化,进而激活AMPK。利用AMPK激动剂AICAR能够有效回复VEGFR3突变体对糖代谢重编程和炎症小体活化的作用。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


