复旦大学邱敏团队开发单组分LNP递送系统,用于mRNA癌症疫苗
来源:生物世界 2025-12-06 17:28
该研究开发了一种基于二甲胺(DMA)类脂分子的单组分 LNP 递送系统——OncoLRC,能够将 mRNA 高效靶向递送至脾脏抗原呈递细胞,并激活强大的抗肿瘤免疫反应。
mRNA 疫苗在预防 COVID-19 方面展现出了强大的临床效果,这主要得益于它们能够迅速诱导出强大的免疫反应。
这一成功推动了基于 mRNA 的癌症疫苗的发展,成为激发强大且特异性抗肿瘤免疫反应的一种很有前景的策略。mRNA 癌症疫苗能够调动先天免疫系统和适应性免疫系统,从而提供全面的抗肿瘤效果。有效地将编码抗原的 mRNA 递送至淋巴器官中的抗原呈递细胞(APC),从而激发强大的抗原特异性细胞免疫和体液免疫,这是 mRNA 癌症疫苗研发成功的关键,但这仍面临着重大挑战。
近日,复旦大学人类表型组研究院邱敏团队在 Advanced Science 期刊发表了题为:A Rationally Engineered Spleen-Tropic One-Component Lipid-mRNA Complex (OncoLRC) for Cancer Vaccines 的研究了。
该研究开发了一种基于二甲胺(DMA)类脂分子的单组分 LNP 递送系统——OncoLRC,能够将 mRNA 高效靶向递送至脾脏抗原呈递细胞,并激活强大的抗肿瘤免疫反应,为开发下一代 mRNA 癌症疫苗提供了一种简单高效的全新递送平台。

脂质纳米颗粒(LNP)是 mRNA 疫苗最先进的递送系统。尽管取得了许多成功,但传统的 LNP 存在一个显著的局限性——系统性给药后易在肝脏中积聚。世界各地的研究人员已投入大量精力开发脾脏选择性靶向的 mRNA-LNP 递送系统。一种策略是在 LNP 配方中加入阴离子脂质,另一种策略是设计具有内在脾脏趋向性的新型可电离脂质。然而,经典的 LNP 是由可电离脂质、胆固醇、磷脂和聚乙二醇脂质组成的四组分配方,其配方过于复杂。最近的研究表明,使用单组分 LNP 系统进行系统性 mRNA 递送,能够靶向脾脏中的 T 细胞和成纤维网状细胞。
在在这项最新研究中,研究团队开发了一种经过理性设计、脾脏趋向性、单组分脂质-mRNA 复合物——OncoLRC,可在系统性给药后将 mRNA 选择性递送至脾脏抗原呈递细胞。
研究团队首先以二甲胺(DMA)作为可电离头部基团,合成系列类脂分子,筛选发现,其中 H2T7 类脂分子的脾脏表达最高,将其作为核心候选成分。然后,通过 “四步优化法” 逐步简化制剂:先调整四组分 LNP 中的脂质与 mRNA 比例,发现带轻微负电的颗粒虽能改善脾脏靶向,但无法完全消除肝脏富集;随后去除胆固醇、磷脂、聚乙二醇脂质等辅助成分,最终确定了仅含有 H2T7 的单组分体系,并将其命名为 OncoLRC。
OncoLRC 配方能够实现近乎专一的脾脏靶向的 mRNA 递送,效果优于传统的四组分 LNP 配方。体内实验显示,静脉注射 OncoLRC 后,mRNA 几乎完全在脾脏抗原呈递细胞中表达。

值得注意的是,OncoLRC 要求脂质与 mRNA 的重量比为 1.5:1,而标准 LNP 的典型比例为 10:1。使用 OncoLRC 递送卵清蛋白(OVA)mRNA(OncoLRCOVA),可促进树突状细胞(DC)的成熟和活化,从而引发强烈的抗原特异性免疫反应。
进一步机制研究表明,OncoLRC 的脾脏递送主要通过巨胞饮作用介导。
该研究还显示,OncoLRCOVA 还能增强内源性细胞因子(例如 IL-12)的分泌,进一步刺激 T 细胞的活化和细胞毒性活性。在 B16F10-OVA 冷肿瘤模型中,OncoLRCOVA 表现出强大的预防性抗肿瘤功效,并且与免疫检查点阻断(ICB)疗法联合使用时,能产生显著的协同效应,从而有效抑制肿瘤生长。
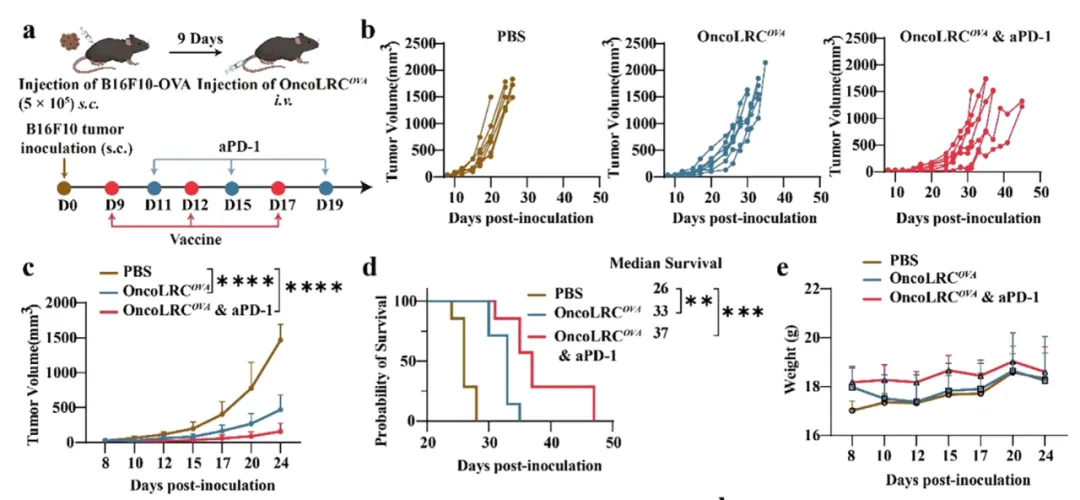
总的来说,该研究开发的 OncoLRC 递送系统,突破了传统 LNP-mRNA 递送系统组分复杂以及肝脏累积的局限,能够简单、高效的将 mRNA 选择性递送至脾脏抗原呈递细胞,并激活强大的抗肿瘤免疫反应,突显了其作为下一代 mRNA 癌症疫苗系统的潜力。
论文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202512535
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


