作用于HIV感染关键环节,融合抑制剂安全有效
来源:生物谷 2021-11-24 10:45
艾滋病,又称获得性免疫缺陷综合征(AIDS),是由于机体感染人类免疫缺陷病毒(HIV),进而引发的全身性疾病。
艾滋病,又称获得性免疫缺陷综合征(AIDS),是由于机体感染人类免疫缺陷病毒(HIV),进而引发的全身性疾病。据联合国艾滋病规划署发布的《2021艾滋病防治全球进展报告》披露:截止2020年,全球有3770万人感染了艾滋病病毒,其中包括170万0-14岁的儿童,全世界约有68万人死于艾滋病相关疾病;到2020年底,全世界约有2750万人正在接受抗反转录病毒治疗。
艾滋病病因主要是由于HIV病毒侵袭人体的免疫系统,感染CD4+T淋巴细胞、单核巨噬细胞和树突状细胞等,主要表现为CD4+T淋巴细胞数量不断减少,最终导致人体细胞免疫功能缺陷,引起各种机会性感染和肿瘤的发生,未经治疗的感染者在疾病晚期易于并发各种严重感染和恶性肿瘤,最终导致死亡。HIV病毒进入人体后,在24~48小时到达局部淋巴结,5天左右在外周血中可以检测到病毒成分,继而产生病毒血症,导致急性感染,以CD4+T淋巴细胞数量短期内一过性迅速减少为特点(正常人体CD4细胞数目:500-1600个/ /μL)。
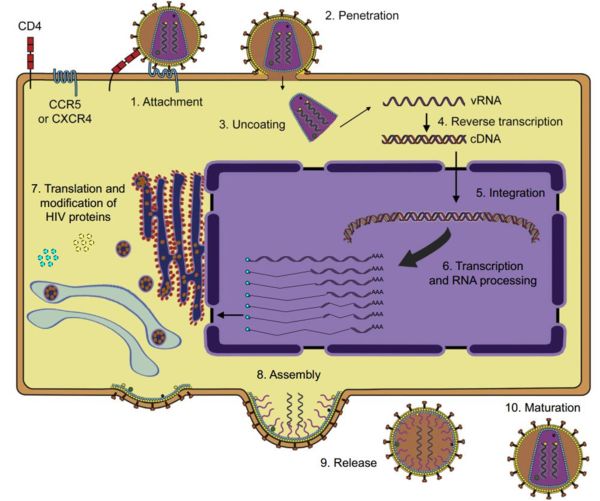
HIV病毒侵入机体的复制过程
基于大量的研究结果,全球抗艾滋病领域已经达成了“发现即治疗”的共识,确立了抗反转录病毒治疗以维持病毒学抑制、预防病毒传播、减少艾滋病相关疾病、改善生活质量以及延长患者寿命的核心目标。高效抗反转录病毒治疗(HAART),是通过三种或三种以上的抗病毒药物联合使用来治疗艾滋病,即鸡尾酒疗法。该疗法的应用可以减少单一用药产生的抗药性,最大限度地抑制病毒的复制,使被破坏的机体免疫功能部分甚至全部恢复,从而延缓病程进展,延长患者生命,提高生活质量。迄今为止,全球范围内已上市抗HIV治疗药物30余款,根据药物作用靶点的不同,这些抗病毒药物主要分为核苷类反转录酶抑制剂(NRTIs)、非核苷类反转录酶抑制剂(NNRTIs)、蛋白酶抑制剂(PIs)、整合酶抑制剂(INSTIs)、融合抑制剂(FIs)、CCR5受体拮抗剂等。
核苷类反转录酶抑制剂(NRTIs)是最先被批准的一类抗HIV药物,通过竞争性抑制天然核苷与HIV-1反转录酶结合,阻止病毒DNA链的延长和复制。长期用药的不良反应依然是NRTIs的主要问题,如药物超敏反应、肾功能障碍和骨代谢异常等。
非核苷类反转录酶抑制剂(NNRTIs)与反转录酶结合,抑制酶活性,从而阻断HIV病毒复制。NNRTIs具有很强的抗病毒活性,但其临床应用受到不良反应、药物相互作用和耐药屏障较低的限制。NNRTIs通过细胞色素P450酶(CYP450)代谢,主要不良反应包括中枢神经系统(CNS)症状、肝毒性、皮疹、抑郁、失眠等精神障碍。NNRTIs的耐药屏障较低,容易产生交叉耐药,是目前耐药率最高的一类抗HIV药物。
蛋白酶抑制剂(PIs)通过抑制蛋白酶的水解活性,阻止病毒前蛋白的裂解和形成成熟的感染性病毒粒子。PIs具有较强的抗病毒活性和较高的耐药屏障,但存在特异性不良反应,包括血脂异常、胰岛素抵抗、高血糖、脂肪代谢障碍。此外,PIs主要经P450酶代谢,是CYP3A4的抑制剂,药物相互作用较为常见,还可能增加HIV阳性的血友病患者的出血风险。
整合酶抑制剂(INSTIs)又称整合酶链转移反应抑制剂,通过竞争性结合整合酶的活化位点,抑制病毒互补脱氧核糖核酸(cDNA)整合入宿主基因组的链转移环节,从而阻断HIV病毒复制。INSTIs抗病毒疗效显著,可以快速降低病毒载量(HIV-RNA),且一般都有很好的耐受性,已成为发达国家一线治疗方案的首选药物。整合酶是抗HIV治疗的已被验证靶点之一。
融合抑制剂(FIs)是一类新的抗反转录病毒药物,HIV-1融合抑制剂是一些天然或合成的多肽以及小分子化合物, 通过与gp41功能区结合从而抑制其促融合功能的发挥,以HIV-1跨膜糖蛋白gp41为作用靶标, 作用于病毒生命周期最早期的关键环节,干扰HIV与宿主细胞的黏附或融合。FIs在临床治疗上表现出良好的有效性和安全性。近年来, 随着对膜融合过程分子机制以及gp41功能研究的不断深入, 新的以gp41不同功能区为靶点的融合抑制剂分子不断被发现, 成为近年来主要研究热点之一。
CCR5受体拮抗剂通过抑制CCR5辅助受体与病毒包膜蛋白gp120的结合而阻断病毒进入宿主细胞。临床组合使用中易暴露出一些不良反应,需在治疗前进行病毒嗜性检测,一定程度上限制了其临床使用。
随着鸡尾酒疗法在临床上的应用和推广,艾滋病已经由高死亡率传染性疾病转变为一个需要终身治疗的慢性疾病。鸡尾酒疗法需每日服药,且部分药物需每日服用2或3次,给药频率较高,其弊端在于多种药物同时服用将导致药物-药物和药物-食物的相互作用,长期治疗也不可避免地带来毒副作用和产生耐药病毒。除此之外,服药依从性也是严重问题。在接受了多年每日高效抗反转录病毒治疗后,许多患者出现治疗疲劳,仅有不到2/3的患者能够保持获得最佳病毒学抑制所需要的 90% 的服药依从性。
作为反转录病毒,HIV病毒具有复制快、变异频率非常高等特点,每天可产生数百亿新的病毒颗粒。在美国国立卫生研究院(NIH)官网发布的一篇文章中提到,超过150个已知的突变与HIV耐药有关,抗反转录病毒治疗6年的累积耐药性预计可达到27%。长期的抗病毒治疗对药物的安全性和耐药屏障提出了更高的要求,大量科学研究表明,长效药物或缓释制剂可为艾滋病的治疗和预防提供新选择,作为一种新策略解决患者依从性差和治疗疲劳的问题。
综合比对以上几类抗病毒药物作用特征,融合抑制剂(FIs)在临床应用中显现了全新的作用机制,也是近年来在艾滋病治疗领域寻找突破的主流研究方向之一。HIV-1感染宿主细胞是一个复杂的过程, 包括吸附、进入、脱壳、反转录、整合、复制、转录、翻译、装配、成熟等各个阶段。HIV-1通过吸附及膜融合进入靶细胞后, 结构破裂, 释放出遗传物质RNA和反转录酶, 进行反转录, 合成的cDNA通过整合酶整合到感染细胞的染色体中, 变成潜在病毒。HIV-1融合抑制剂是继反转录酶和蛋白酶抑制剂后的新一类抗HIV感染药物, 通过阻断病毒与靶细胞膜的融合从而抑制病毒进入靶细胞, 在感染的初始环节切断HIV-1的传播。以我国制药企业前沿生物药业(南京)股份有限公司自主研发的长效HIV融合抑制剂艾可宁®(通用名:艾博韦泰)为例,上市后在临床治疗中体现了其广谱、长效、起效快、高安全性、强有效性以及药物相互作用小等特征。艾可宁在分子结构、多肽序列及化学修饰、作用靶点以及在人体内的分布与代谢上均实现了技术突破。以艾可宁为核心通过与其他抗反转录病毒药物联合使用,为经治患者搭建的新型、简化两药疗法,主要针对住院及重症患者、肝肾功能异常患者、耐药患者,具有一定的临床不可替代性。
艾博韦泰(ABT)是一种以HIV病毒膜蛋白gp41为靶点的长效融合抑制剂,由34个氨基酸和一个修饰化学基团组成。艾博韦泰作用于HIV-1病毒感染的第一环节,与靶点HIV-1膜蛋白gp41结合,抑制病毒膜与人体CD4细胞膜融合,从而阻止HIV-1病毒进入细胞,发挥其抗病毒作用。艾博韦泰通过其侧链修饰基团与血液中白蛋白发生1:1分子比的特异性结合,形成稳定的共轭体而延长其体内半衰期,实现长效的功能。
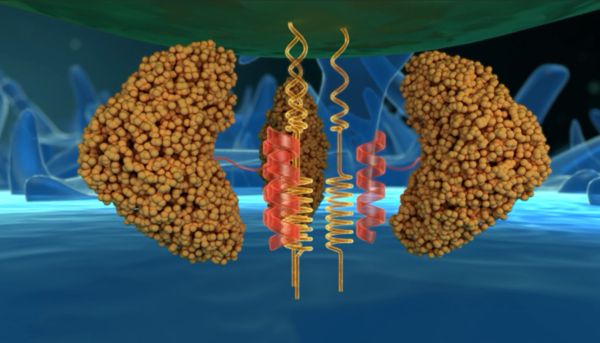
长效融合抑制剂艾博韦泰作用机制
在2021年第11届国际艾滋病协会艾滋病科学大会(IAS)上,前沿生物公布了艾博韦泰Ⅲ期临床试验(TALENT研究)的主要研究成果;TALENT研究是全球首个使用包含长效注射药物的二药配方治疗初治失败的HIV感染者的Ⅲ期临床试验,是中国第一个原创艾滋病新药Ⅲ期临床试验,也是第一个全部以亚洲人群为研究对象的艾滋病新药注册临床试验。该研究结果显示,以艾博韦泰为核心取代两个NRTIs的两药方案治疗初治失败的HIV-1感染者,患者可以获得快速持久的病毒抑制,治疗48周不劣于标准二线三药联合治疗。艾博韦泰具有高耐药屏障,无注射位点反应,长期每周一次注射给药良好的依从性,总体安全性好的优点。
今年,联合国艾滋病规划署向全球呼吁,希望各国加大投入、支持各项疾病大流行的响应力度,力争在2030年前终结艾滋病这一公共卫生威胁。在没有有效的疫苗和根除HIV病毒治疗方法的环境下,艾滋病的预防和治疗仍存在重大的临床需求,以新复方单片制剂、长效注射药物、新作用机制药物、广谱中和抗体为代表的免疫治疗、无药缓解和功能性治愈将是未来抗艾滋病药物研发的热点和重点,也会在不久的将来取得重大突破,推动艾滋病防控进程。(生物谷 bioon)
艾滋病病因主要是由于HIV病毒侵袭人体的免疫系统,感染CD4+T淋巴细胞、单核巨噬细胞和树突状细胞等,主要表现为CD4+T淋巴细胞数量不断减少,最终导致人体细胞免疫功能缺陷,引起各种机会性感染和肿瘤的发生,未经治疗的感染者在疾病晚期易于并发各种严重感染和恶性肿瘤,最终导致死亡。HIV病毒进入人体后,在24~48小时到达局部淋巴结,5天左右在外周血中可以检测到病毒成分,继而产生病毒血症,导致急性感染,以CD4+T淋巴细胞数量短期内一过性迅速减少为特点(正常人体CD4细胞数目:500-1600个/ /μL)。

HIV病毒侵入机体的复制过程
基于大量的研究结果,全球抗艾滋病领域已经达成了“发现即治疗”的共识,确立了抗反转录病毒治疗以维持病毒学抑制、预防病毒传播、减少艾滋病相关疾病、改善生活质量以及延长患者寿命的核心目标。高效抗反转录病毒治疗(HAART),是通过三种或三种以上的抗病毒药物联合使用来治疗艾滋病,即鸡尾酒疗法。该疗法的应用可以减少单一用药产生的抗药性,最大限度地抑制病毒的复制,使被破坏的机体免疫功能部分甚至全部恢复,从而延缓病程进展,延长患者生命,提高生活质量。迄今为止,全球范围内已上市抗HIV治疗药物30余款,根据药物作用靶点的不同,这些抗病毒药物主要分为核苷类反转录酶抑制剂(NRTIs)、非核苷类反转录酶抑制剂(NNRTIs)、蛋白酶抑制剂(PIs)、整合酶抑制剂(INSTIs)、融合抑制剂(FIs)、CCR5受体拮抗剂等。
核苷类反转录酶抑制剂(NRTIs)是最先被批准的一类抗HIV药物,通过竞争性抑制天然核苷与HIV-1反转录酶结合,阻止病毒DNA链的延长和复制。长期用药的不良反应依然是NRTIs的主要问题,如药物超敏反应、肾功能障碍和骨代谢异常等。
非核苷类反转录酶抑制剂(NNRTIs)与反转录酶结合,抑制酶活性,从而阻断HIV病毒复制。NNRTIs具有很强的抗病毒活性,但其临床应用受到不良反应、药物相互作用和耐药屏障较低的限制。NNRTIs通过细胞色素P450酶(CYP450)代谢,主要不良反应包括中枢神经系统(CNS)症状、肝毒性、皮疹、抑郁、失眠等精神障碍。NNRTIs的耐药屏障较低,容易产生交叉耐药,是目前耐药率最高的一类抗HIV药物。
蛋白酶抑制剂(PIs)通过抑制蛋白酶的水解活性,阻止病毒前蛋白的裂解和形成成熟的感染性病毒粒子。PIs具有较强的抗病毒活性和较高的耐药屏障,但存在特异性不良反应,包括血脂异常、胰岛素抵抗、高血糖、脂肪代谢障碍。此外,PIs主要经P450酶代谢,是CYP3A4的抑制剂,药物相互作用较为常见,还可能增加HIV阳性的血友病患者的出血风险。
整合酶抑制剂(INSTIs)又称整合酶链转移反应抑制剂,通过竞争性结合整合酶的活化位点,抑制病毒互补脱氧核糖核酸(cDNA)整合入宿主基因组的链转移环节,从而阻断HIV病毒复制。INSTIs抗病毒疗效显著,可以快速降低病毒载量(HIV-RNA),且一般都有很好的耐受性,已成为发达国家一线治疗方案的首选药物。整合酶是抗HIV治疗的已被验证靶点之一。
融合抑制剂(FIs)是一类新的抗反转录病毒药物,HIV-1融合抑制剂是一些天然或合成的多肽以及小分子化合物, 通过与gp41功能区结合从而抑制其促融合功能的发挥,以HIV-1跨膜糖蛋白gp41为作用靶标, 作用于病毒生命周期最早期的关键环节,干扰HIV与宿主细胞的黏附或融合。FIs在临床治疗上表现出良好的有效性和安全性。近年来, 随着对膜融合过程分子机制以及gp41功能研究的不断深入, 新的以gp41不同功能区为靶点的融合抑制剂分子不断被发现, 成为近年来主要研究热点之一。
CCR5受体拮抗剂通过抑制CCR5辅助受体与病毒包膜蛋白gp120的结合而阻断病毒进入宿主细胞。临床组合使用中易暴露出一些不良反应,需在治疗前进行病毒嗜性检测,一定程度上限制了其临床使用。
随着鸡尾酒疗法在临床上的应用和推广,艾滋病已经由高死亡率传染性疾病转变为一个需要终身治疗的慢性疾病。鸡尾酒疗法需每日服药,且部分药物需每日服用2或3次,给药频率较高,其弊端在于多种药物同时服用将导致药物-药物和药物-食物的相互作用,长期治疗也不可避免地带来毒副作用和产生耐药病毒。除此之外,服药依从性也是严重问题。在接受了多年每日高效抗反转录病毒治疗后,许多患者出现治疗疲劳,仅有不到2/3的患者能够保持获得最佳病毒学抑制所需要的 90% 的服药依从性。
作为反转录病毒,HIV病毒具有复制快、变异频率非常高等特点,每天可产生数百亿新的病毒颗粒。在美国国立卫生研究院(NIH)官网发布的一篇文章中提到,超过150个已知的突变与HIV耐药有关,抗反转录病毒治疗6年的累积耐药性预计可达到27%。长期的抗病毒治疗对药物的安全性和耐药屏障提出了更高的要求,大量科学研究表明,长效药物或缓释制剂可为艾滋病的治疗和预防提供新选择,作为一种新策略解决患者依从性差和治疗疲劳的问题。
综合比对以上几类抗病毒药物作用特征,融合抑制剂(FIs)在临床应用中显现了全新的作用机制,也是近年来在艾滋病治疗领域寻找突破的主流研究方向之一。HIV-1感染宿主细胞是一个复杂的过程, 包括吸附、进入、脱壳、反转录、整合、复制、转录、翻译、装配、成熟等各个阶段。HIV-1通过吸附及膜融合进入靶细胞后, 结构破裂, 释放出遗传物质RNA和反转录酶, 进行反转录, 合成的cDNA通过整合酶整合到感染细胞的染色体中, 变成潜在病毒。HIV-1融合抑制剂是继反转录酶和蛋白酶抑制剂后的新一类抗HIV感染药物, 通过阻断病毒与靶细胞膜的融合从而抑制病毒进入靶细胞, 在感染的初始环节切断HIV-1的传播。以我国制药企业前沿生物药业(南京)股份有限公司自主研发的长效HIV融合抑制剂艾可宁®(通用名:艾博韦泰)为例,上市后在临床治疗中体现了其广谱、长效、起效快、高安全性、强有效性以及药物相互作用小等特征。艾可宁在分子结构、多肽序列及化学修饰、作用靶点以及在人体内的分布与代谢上均实现了技术突破。以艾可宁为核心通过与其他抗反转录病毒药物联合使用,为经治患者搭建的新型、简化两药疗法,主要针对住院及重症患者、肝肾功能异常患者、耐药患者,具有一定的临床不可替代性。
艾博韦泰(ABT)是一种以HIV病毒膜蛋白gp41为靶点的长效融合抑制剂,由34个氨基酸和一个修饰化学基团组成。艾博韦泰作用于HIV-1病毒感染的第一环节,与靶点HIV-1膜蛋白gp41结合,抑制病毒膜与人体CD4细胞膜融合,从而阻止HIV-1病毒进入细胞,发挥其抗病毒作用。艾博韦泰通过其侧链修饰基团与血液中白蛋白发生1:1分子比的特异性结合,形成稳定的共轭体而延长其体内半衰期,实现长效的功能。

长效融合抑制剂艾博韦泰作用机制
在2021年第11届国际艾滋病协会艾滋病科学大会(IAS)上,前沿生物公布了艾博韦泰Ⅲ期临床试验(TALENT研究)的主要研究成果;TALENT研究是全球首个使用包含长效注射药物的二药配方治疗初治失败的HIV感染者的Ⅲ期临床试验,是中国第一个原创艾滋病新药Ⅲ期临床试验,也是第一个全部以亚洲人群为研究对象的艾滋病新药注册临床试验。该研究结果显示,以艾博韦泰为核心取代两个NRTIs的两药方案治疗初治失败的HIV-1感染者,患者可以获得快速持久的病毒抑制,治疗48周不劣于标准二线三药联合治疗。艾博韦泰具有高耐药屏障,无注射位点反应,长期每周一次注射给药良好的依从性,总体安全性好的优点。
今年,联合国艾滋病规划署向全球呼吁,希望各国加大投入、支持各项疾病大流行的响应力度,力争在2030年前终结艾滋病这一公共卫生威胁。在没有有效的疫苗和根除HIV病毒治疗方法的环境下,艾滋病的预防和治疗仍存在重大的临床需求,以新复方单片制剂、长效注射药物、新作用机制药物、广谱中和抗体为代表的免疫治疗、无药缓解和功能性治愈将是未来抗艾滋病药物研发的热点和重点,也会在不久的将来取得重大突破,推动艾滋病防控进程。(生物谷 bioon)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


