HIF-1招募NANOG作为低氧乳腺癌干细胞中TERT基因转录的共激活因子
来源:本站原创 2021-10-09 13:08
乳腺癌干细胞在肿瘤形成、耐药、复发和转移中发挥着重要作用。NANOG是干细胞自我更新所必需的一种蛋白质,但其实现这一功能的机制尚不清楚。
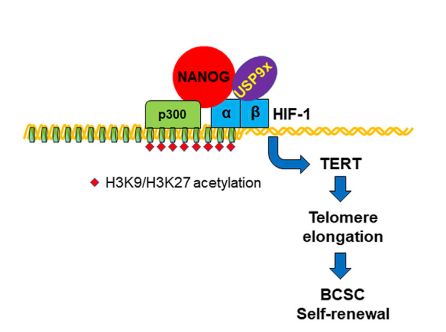
乳腺癌干细胞在肿瘤形成、耐药、复发和转移中发挥着重要作用。NANOG是干细胞自我更新所必需的一种蛋白质,但其实现这一功能的机制尚不清楚。在这里,作者证明了缺氧诱导因子1a (HIF-1a)是nanog介导的BCSC富集所必需的。在机制上,NANOG被HIF-1招募,协同激活TERT基因的转录,TERT基因编码端粒酶逆转录酶,维持端粒长度,这是干细胞自我更新所必需的。
NANOG通过募集去泛素酶USP9X(抑制HIF-1a蛋白降解)和稳定HIF-1a与共激活因子p300(介导组蛋白乙酰化)的相互作用来刺激HIF-1的转录活性。该研究结果揭示了HIF-1和NANOG介导BCSC自我更新的协同转录机制。
图片来源:https://doi.org/10.1016/j.celrep.2021.109757
乳腺癌(BC)干细胞(BCSCs)是由其无限的增殖潜能和肿瘤起始特性定义的。BCSCs在复发和转移中起着关键作用,这是导致bc相关死亡的主要原因。BCSC 与胚胎干细胞 (ESC) 具有自我更新能力和共同的基因表达特征,并且与 ESC 一样,BCSC 的维持依赖于转录因子 NANOG 以及其他 ESC 多能性因子 SOX2 和 OCT4 的表达。
乳腺球形成细胞和醛脱氢酶表达(ALDH+)细胞是BCSCs高度富集的BC亚群。雌激素受体阳性(ER+)、HER2+或ER BC细胞暴露于缺氧诱导BCSCs增加。在之前的研究中,作者发现当BC细胞被培养成乳腺球时,NANOG的表达增加了10倍。NANOG
在缺氧癌细胞中表达,但其特异性bcscs和维持自我更新的分子机制尚不清楚。
端粒是真核生物染色体末端的重复核苷酸序列。在大多数细胞中,端粒随着每次细胞分裂而缩短,端粒的最终丢失导致复制性衰老或凋亡。端粒长度由端粒酶维持,是ESC和癌干性的先决条件。端粒酶由蛋白质亚基、端粒酶逆转录酶(TERT)和提供TERT模板的RNA亚基组成。在成年体细胞中,TERT的表达受到抑制,但在BC中又被激活。在BCSCs中观察到TERT基因表达和端粒酶活性,但其在BCSCs中激活TERT的机制尚未明确。
肿瘤内缺氧是晚期BC的一个共同特征,它通过影响代谢、血管生成、侵袭、转移、BCSC维持和免疫逃避而推动进展。缺氧诱导因子(hif)由O2调控的HIF-1a或HIF-2a亚基和组成表达的HIF-1b亚基组成。hif在正常组织和癌症的干细胞中都发挥着重要作用。低氧通过多个hif -1依赖的途径诱导BCSC的特异性。HIF-1介导的缺氧诱导TERT表达在绒毛膜癌、宫颈癌、甲状腺乳头状癌以及ESCs中均有报道,但限制HIF-1依赖性TERT表达到干细胞的机制尚不清楚。在本研究中,作者证明了HIF-1a对于nanog介导的BCSC规范是必需的。NANOG通过招募去泛素酶USP9X和稳定HIF-1a与p300的相互作用,作为TERT转录的HIF-1共激活剂。
HIF-1招募NANOG作为低氧乳腺癌干细胞中TERT基因转录的共激活因子
图片来源:https://doi.org/10.1016/j.celrep.2021.109757
虽然已经证实了TERT在BCSCs中的关键作用,但TERT激活的机制尚未明确。在这项研究中作者已经表明,在低氧的情况下, HIF-1 将 NANOG 募集到
TERT 启动子,并且 NANOG 通过两种不同的机制增强
HIF-1 转录活性,这些机制涉及与 USP9X、一种抑制
HIF-1a 降解的去泛素化酶和 p300 ,一种催化
H3K9 和 H3K27 乙酰化的共激活剂,使 RNA 聚合酶 II 能够解开核小体并将 DNA 转录成 RNA。作者证明缺氧诱导的BCSC规范是一种协同反应,需要NANOG和HIF-1。作者还发现NANOG被招募到缺氧BC细胞中HIF-1靶基因的一个选择亚群中,这表明这种合作并不局限于TERT调控。NTC和NANOG- kd细胞的RNA测序将使作者能够确定HIF-1靶基因转录在多大程度上需要NANOG。
除了直接抑制端粒酶活性外,旨在诱导tert特异性细胞毒性T淋巴细胞反应的疫苗正在临床试验中。该研究表明,靶向端粒酶和/或HIF-1的治疗提供了一种消除BCSCs的策略。最佳的治疗效果可能是联合化疗或其他靶向肿瘤细胞的药物。(生物谷
Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



