Gastroenterology:研究通过单细胞基因组测序揭示肝细胞癌的双相拷贝数演化模型
来源:北大医院 2021-09-15 07:12
胃肠病学领域学术期刊Gastroenterology以长文形式在线发表了北京大学第一医院肿瘤转化研究中心张宁课题组的研究成果。在题为“Single cell DNA sequencing reveals punctuated and gradual clonal evolution in hepatocellular carcinoma”的研究论文中,研究人
胃肠病学领域学术期刊Gastroenterology以长文形式在线发表了北京大学第一医院肿瘤转化研究中心张宁课题组的研究成果。在题为“Single cell DNA sequencing reveals punctuated and gradual clonal evolution in hepatocellular carcinoma”的研究论文中,研究人员综合利用单细胞测序、模型构建和大规模数据及实验验证,系统探究了肝癌单细胞层面的基因组特征,首次提出了肝癌的间断和渐进的双相演化模式(DPCNE),揭示了肝癌中双相演化模式与肿瘤内内异质性以及预后的关系,首次在单细胞水平证实多倍体肝癌起源于二倍体细胞,并发现了新的预后标志物CAD。这些结果为肝癌的临床诊断、预后和治疗提供了关键信息。
肝细胞癌(简称肝癌)约占原发性肝癌的80%,其致死率在所有癌症中高居第三位。现有靶向治疗和免疫治疗在肝癌中的响应率及治疗效果非常有限,而肿瘤异质性是其耐药、复发和预后差的重要原因之一。张宁课题组近年来一直聚焦于肝癌异质性探究,通过一系列前期工作揭示了肝癌多发病灶的异质性和表型异质性(Gastroenterology,2016;Cancer Cell,2019)。然而,先前的研究多是基于组织水平的探究,这些结果只反映了不同亚克隆的平均特征,肝癌在单细胞水平的异质性仍不清楚。基因组不稳定性引起的拷贝数变异(CNA)是肿瘤异质性产生的主要来源。到目前为止,肝癌的CNA积累遵循渐进演化(GCNE)还是间断演化(PCNE)仍缺乏探究。
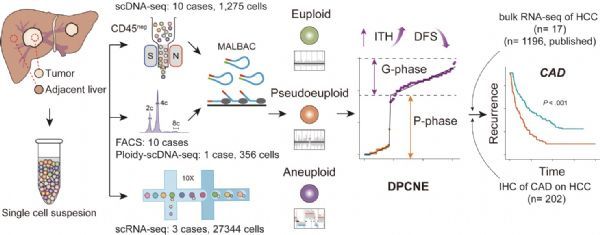
在近期的研究中,课题组收集新鲜或冰冻的肝癌组织以及相对应的癌旁组织,通过单细胞DNA测序完成了10例肝癌患者共1275个细胞的低深度全基因组测序,对1例患者的356个细胞进行了基于倍体分析的低深度全基因组测序,并对另外3例患者共27344个细胞进行了单细胞RNA测序。而后研究人员通过17例肝癌及癌旁组织转录组测序、202例组织免疫组化染色、21例已发表的单细胞DNA数据和1196例已发表的RNA数据进行验证(图2)。
研究人员系统分析了10例肝癌病人中单个细胞的拷贝数变异图谱,发现三种不同的细胞亚群:整倍体、假整倍体和异倍体。其次,研究人员通过模型构建发现CNA积累既存在间断演化,也存在渐进演化。进一步综合多个指标进行评估比较,研究人员发现间断和渐进的双相演化模式DPCNE明显优于其他两种模型。研究人员进一步通过3例单细胞RNA测序数据和其他癌种的单细胞DNA测序对DPCNE模型进行了验证。这些结果表明DPCNE能更好地解释肝癌的克隆演化模式,即肿瘤染色体不稳定的初始阶段,CNA会高速率累积,短时间内获得大量CNA,呈现间断式演化,随后是一个明显的渐进演化阶段,CNA数目继续积累(图3)。为了进一步探索肝癌中异质性与临床特征的相关性,研究人员通过计算两两细胞之间的距离(PWD-CNA)评估细胞的异质性程度。基于该参数,研究人员最终发现,渐进演化阶段的延长与肿瘤高异质性和病人早复发密切相关;进而通过综合分析和研究发现,CAD蛋白可以作为肝癌潜在的预后标志物。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->