Cell报道胰腺癌治疗新突破:PD-1抗体+Pin1抑制剂+吉西他滨,可完全清除小鼠肿瘤
来源:医药魔方 2021-08-29 12:45
胰腺导管腺癌(PDAC)是最具侵袭性的实体恶性肿瘤之一,预计到2030年将成为癌症死亡的第二大原因。PDAC对化疗、靶向治疗甚至免疫治疗都具有耐药性,这归因于其固有的肿瘤异质性、高度促结缔组织增生,以及免疫抑制的肿瘤微环境(TME)。肿瘤异质性使肿瘤对旨在阻断单个通路的靶向治疗产生耐药性,因为作为一种代偿机制,多个通路通常同时激活和/或快速上调,特别是在PD
胰腺导管腺癌(PDAC)是最具侵袭性的实体恶性肿瘤之一,预计到2030年将成为癌症死亡的第二大原因。PDAC对化疗、靶向治疗甚至免疫治疗都具有耐药性,这归因于其固有的肿瘤异质性、高度促结缔组织增生,以及免疫抑制的肿瘤微环境(TME)。
肿瘤异质性使肿瘤对旨在阻断单个通路的靶向治疗产生耐药性,因为作为一种代偿机制,多个通路通常同时激活和/或快速上调,特别是在PDAC中,它们是高度异质性的并不断进化。PDAC TME主要由致密结缔组织增生和免疫抑制细胞群控制,这限制了细胞毒性T细胞的应答。肿瘤相关成纤维细胞(CAF)在促进结缔组织增生和免疫抑制性TME方面发挥着核心作用。此外,靶向免疫检查点,如由PD-1及其配体PD-L1介导的检查点,可提高各种癌症患者的生存率。然而,由于肿瘤免疫原性降低,包括PD-L1低表达和免疫抑制TME,PDAC患者的应答率非常低。
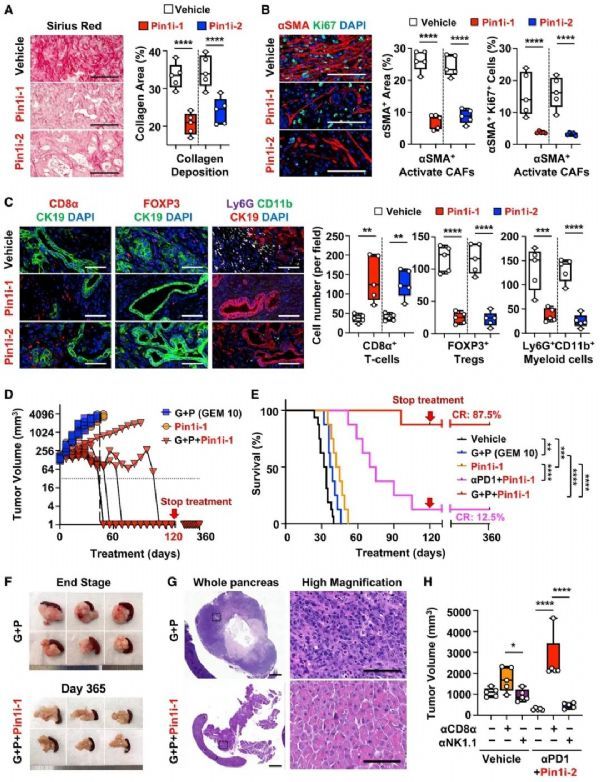
近期,哈佛医学院的研究人员发现一种独特的脯氨酸异构酶Pin1能在TME和癌症免疫治疗中发挥作用。小鼠实验证明,Pin1抑制剂使PDAC可治愈,并且通过与抗PD-1和吉西他滨协同作用,能诱导侵袭性PDAC的完全消除或持续缓解。
这些发现可能对PDAC患者的治疗有直接的影响,因为一些Pin1抑制剂已获批上市。
癌症中一个主要的共同信号机制是脯氨酸定向磷酸化,调节多种癌蛋白和肿瘤抑制因子,其中许多受Pin1进一步调节。异常的Pin1过度激活会通过激活60多种癌蛋白和使30多种肿瘤抑制因子失活来促进肿瘤的发生,包括在PDAC中占主导地位的致癌Kras信号中的许多底物。
这项研究首先通过3种不同的PDAC小鼠模型(均为患者来源的肿瘤异种移植模型)实验证明,Pin1抑制剂(临床可用药物,包括维A酸+三氧化二砷)可显着降低肿瘤生长,阻断CAF激活,并破坏促结缔组织增生和免疫抑制TME。
此外,Pin1抑制剂通过与抗PD-1和吉西他滨(GEM)协同作用,能诱导侵袭性PDAC的完全消除或持续缓解。
鉴于Pin1在使PDAC可治愈方面具有出人意料的惊人效力,研究人员进一步评估了167例PDAC患者手术切除的肿瘤组织中Pin1的表达及其与TME变化和患者存活率的关系。结果显示,Pin1在癌细胞和CAF中都过表达,与癌症进展呈正相关,并且与PDAC患者的低生存率相关。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->