2021年7月Cell期刊不得不看的亮点研究
来源:本站原创 2021-07-31 23:59
2021年7月31日讯/生物谷BIOON/---2021年7月份即将结束了,7月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:挑战常规!感染变形虫的巨病毒也能将它们的DNA组装成类似核小体的结构doi:10.1016/j.cell.2021.06.032对于一些巨病毒(giant virus)来说,一种DNA包装技巧
2021年7月31日讯/生物谷BIOON/---2021年7月份即将结束了,7月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:身体抗击食物中毒的能力竟存在昼夜节律变化
doi:10.1016/j.cell.2021.07.001
在一项新的研究中,来自美国德克萨斯大学西南医学中心的研究人员发现身体通过产生一种天然抗菌化合物来防止食物中毒的能力在白天增强,因为白天最可能暴露于有毒细菌。这一发现最终可能导致人们开发出最大限度地提高这种免疫反应的定时疗法和疫苗接种方案。相关研究结果于2021年7月28日在线发表在Cell期刊上,论文标题为“The microbiota coordinates diurnal rhythms in innate immunity with the circadian clock”。论文通讯作者为德克萨斯大学西南医学中心微生物学教授Lora Hooper博士。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.07.001。
Brooks、Hooper和他们的同事们猜测,肠道内的抗菌免疫力可能在昼夜节律中发生变化。为了研究这个想法,这些作者寻找在小鼠肠道中产生的天然抗菌剂的表达节律,以对抗食源性疾病。他们观察到,在正常的实验室小鼠中,这些抗菌剂分子之一---再生性胰岛源性蛋白3g(regenerating islet-derived protein 3g, REG3G)---在夜间更为丰富,因为这些夜行动物在夜间活动,而在白天小鼠睡觉时则较少。然而,在没有肠道细菌的小鼠中,REG3G在白天和晚上都基本没有。
在寻找驱动这种节律模式的微生物成分时,这些作者发现,具有REG3G数量周期变化的小鼠在它们的肠道中有大量的分节丝状菌(segmented filamentous bacteria),这些细菌通常存在于啮齿动物、非人类灵长类动物和人类中,它们有一种独特的能力,可以附着在肠道内壁上,改变宿主的基因活动。进一步的实验表明,这些细菌在喂养过程中附着在这些小鼠的肠壁上,可能是为了吸走营养物。当它们附着时,REG3G的产量在肠道内激增。
这种周期变化对小鼠抵御感染的能力产生了重大影响。当这些作者用细菌感染正常的小鼠时,如果它们在日落时分比在日出时分暴露于这些细菌,这些小鼠的细菌载量和死亡率更高。不能制造包括REG3G在内的抗菌蛋白的小鼠无论何时被感染,都有类似的高细菌载量和死亡率。
2.Cell:挑战常规!感染变形虫的巨病毒也能将它们的DNA组装成类似核小体的结构
doi:10.1016/j.cell.2021.06.032
对于一些巨病毒(giant virus)来说,一种DNA包装技巧可能对它们的感染性至关重要。称为Marseilleviridae的变形虫感染病毒(Amoeba-infecting virus)将它们的DNA缠绕在它们自己编码 的组蛋白上,就像线轴上松散地包裹着的线。在一项新的研究中,美国霍华德-休斯医学研究所研究员Karolin Luger及其同事们发现,这种包装安排可能有助于Marseilleviridae病毒劫持变形虫的细胞复合物来进行自我复制。相关研究结果于2021年7月22日在线发表在Cell期刊上,论文标题为“Virus-encoded histone doublets are essential and form nucleosome-like structures”。
Luger团队想知道为什么一些巨病毒需要它们自己的组蛋白。该团队用Marseilleviridae病毒科的成员Melbournevirus病毒(可以感染变形虫的巨病毒)进行体外实验,以便发现关于它们的组蛋白功能的线索。他们还剔除了一种巨病毒中的组蛋白基因,然后测试它是否仍能感染宿主细胞。他们发现,它们的组蛋白成对地聚集在一起,形成不稳定的核小体样颗粒。这些摇摆不定的颗粒具有独特的结构和行为特性,有助于巨病毒感染它们的宿主细胞。与大多数入侵宿主细胞的细胞核进行复制的病毒不同,这种巨病毒停留在宿主细胞的细胞质中,即细胞核外的含水区域。Luger说,“这真的很奇怪。细胞核里有很多DNA,那么为什么这些组蛋白不去那里组装宿主的DNA呢?”
在受感染变形虫的细胞质内的“病毒工厂”中,这种巨病毒将其DNA包装成束。这些作者发现,这些DNA束不如真核生物的核小体那样稳定和紧凑。这种松散的包装可以使病毒的基因组更容易接近,让宿主蛋白复制病毒增殖所需的基因。他们发现,如果没有组蛋白,这种巨病毒就不能组装它的DNA,也不能成功感染变形虫。
3.Cell:新研究揭示结核杆菌的脆弱性基因和非脆弱性基因
doi:10.1016/j.cell.2021.06.033
开发防治结核病的药物可能是一件令人沮丧的事情。一旦发现对细菌的生命周期至关重要的基因,科学家们急于开发抑制该靶标的药物,然后是失望。一系列靶向必需基因靶标的化合物对结核杆菌的生长几乎没有影响。这种细菌继续生存。科学家们又回到了原点。如今
,一项新的研究有助于解释为何基于靶标的抗生素在起步阶段遇到如此多的麻烦。一个答案是,必需基因靶标在对抗生素的脆弱程度上有所不同。来自美国洛克菲勒大学和威尔康乃尔医学院的研究人员发现,理想的靶标是如此容易受到攻击,以至于当它被轻微抑制时,
细胞就无法生存。另一方面,非脆弱性基因(invulnerable gene)可以经受住几乎完全的抑制,在遭受抗生素的攻击时也能勉强维持足够的靶标活性而使细胞存活。此外,这些作者首次对病原体的脆弱性进行了量化,产生了一个指数,用于根据使基因失效并使细胞瘫痪
所需的抑制量对结核杆菌中的几乎每一个必需基因进行排名。相关研究结果于2021年7月22日在线发表在Cell期刊上,论文标题为“Genome-wide gene expression tuning reveals diverse vulnerabilities of M. tuberculosis”。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.06.033。
论文共同第一作者、Rock实验室医生科学家Barbara Bosch说,“我们开发了一种可以调整的系统,从没有抑制到几乎100%的抑制。这使我们能够确定这种细菌是否有严重的适应度成本(fitness cost),或者它们是否仍然活着和活跃。”
由此产生的脆弱性指数,将抑制百分比与细菌的适应度联系起来,表明脆弱性是决定抗生素是否成功的一个关键因素。例如,两个最脆弱的基因恰好也是市场上两种最强效的抗结核病药物的靶标。相反,两个最不脆弱的基因,即coaA和def,曾经是很有希望的药物靶标, 但是靶向这些基因的抗生素却未能杀死这种细菌。这些靶标的非脆弱性可能是这些药物失败的一个原因。
这种脆弱性指数还确定了几个新的靶标,这些靶标是必需的,高度脆弱的,而且是药物开发商尚未探索的。其中的一些靶标甚至比目前的一线抗结核病药物更脆弱,并令人吃惊地影响着细胞中的各种活动。
4.Cell:首次构建出整个神经系统的完整基因表达图谱
doi:10.1016/j.cell.2021.06.023
人类的大脑有1000亿个神经元,而秀丽隐杆线虫只有302个。秀丽隐杆线虫雌雄同体共存在118种神经元类型。在一项新的研究中,美国范德堡大学细胞与发育生物学系研究助理教授Seth Taylor和David Miller教授与来自哥伦比亚大学和耶鲁大学的研究人员一起构建出秀丽隐杆线虫(Caenorhabditis elegans)雌雄同体神经系统中所有神经元的基因表达图谱。他们的数据补充了这种线虫神经系统的已知接线图,首次绘制了整个神经系统中每个神经元的基因表达的完整图谱。相关研究结果近期发表在Cell期刊上,论文标题为“Molecular topography of an entire nervous system”。
这些作者使用范德堡大学开发的流式细胞仪方法来捕捉每一种类型神经元的基因表达谱,并将这些数据分享给任何人,以研究神经元中的单个基因如何对神经系统的功能作出贡献。为了说明这种方法,他们使用计算方法来确定控制特定神经元中基因表达的DNA区域,以及可能维持突触形成的粘附蛋白,其中突触是神经元之间的连接,所有的大脑活动都是从突触开始的。
他们的研究结果表明,每种神经元类型可以完全通过特定基因家族的组合表达来识别。比如,每种神经元类型表达大约23个神经肽基因和大约36个神经肽受体的不同编码,勾勒出一个复杂而广泛的“无线”信号网络。为了展示这个全面的基因表达目录的实用性,他们用计算方法确定了神经元特异性基因表达的顺式调控序列元件,并揭示了在突起定位和突触特异性方面具有潜在作用的粘附蛋白。他们的基因表达数据可在https://cengen.org访问,并可在网络应用程序Cengenapp进行查询。他们期望这个神经元特异性基因表达目录将刺激对确定秀丽隐杆线虫整个神经系统的解剖结构、连接和功能的潜在机制的调查。
5.Cell:揭示DNA修复蛋白RAD51可让CRISPR基因编辑更高效
doi:10.1016/j.cell.2021.04.035
基因编辑是有目的地改变基因的DNA序列,是研究突变如何导致疾病,以及为治疗目的改变一个人的DNA的有力工具。在一项新的研究中,美国麻省理工学院大脑与认知科学教授Guoping Feng及其团队开发出一种可用于这两种目的的新型基因编辑方法。相关研究结果近期
发表在Cell期刊上,论文标题为“Efficient embryonic homozygous gene conversion via RAD51-enhanced interhomolog repair”。
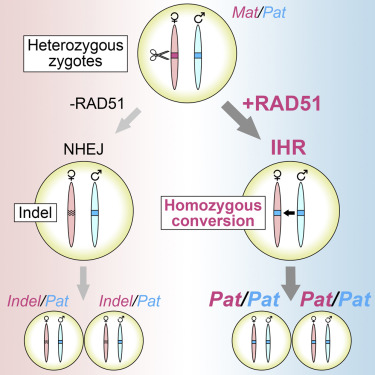
图片来自Cell, 2021, doi:10.1016/j.cell.2021.04.035。
Feng实验室接下来着手了解RAD51增强基因编辑的机制。他们假设RAD51参与了一种叫做同源体间修复(interhomolog repair, IHR)的过程,即一条染色体上的DNA断裂以该染色体的第二个拷贝(来自另一个亲本)为模板进行修复。为了测试这一点,他们给小鼠胚胎注射 了RAD51和CRISPR,但没有注射模板DNA。他们对CRISPR进行编程,只切割其中一条染色体上的基因序列,然后测试它是否被修复以匹配未切割染色体拷贝上的序列。在这个实验中,他们不得不使用母体和父体染色体上的序列不同的小鼠。他们发现,单独注射CRISPR的对 照组胚胎很少出现IHR修复。然而,添加RAD51显著增加了编辑CRISPR靶向基因以匹配未切割染色体拷贝的胚胎数量。
Wilde说,“以前对IHR的研究已发现,它在大多数细胞中的效率低得惊人。我们发现它在胚胎细胞中更容易发生,并且可以被RAD51增强,这表明更深入地了解是什么使胚胎允许这种类型的DNA修复,可能帮助我们设计更安全和更有效的基因疗法。”
6.Cell:富含发酵食物的饮食方式或能增加机体微生物组的多样性并能帮助降低机体炎症水平
doi:10.1016/j.cell.2021.06.019
饮食可以调节机体肠道微生物组,从而影响机体免疫系统的功能;近日,一篇发表在国际杂志Cell上题为“Gut-microbiota-targeted diets modulate human immune status”的研究报告中,来自斯坦福大学医学院等机构的科学家们通过研究发现,富含发酵食物的饮食方式或能增强机体肠道菌群的多样性并降低炎性分子信号的水平。
研究者表示,在一项临床试验中,他们招募了36名健康成年人,将其随机分配到为期10周的饮食模式中,其中包括发酵食物或高纤维食物,这两种饮食方式会对机体肠道微生物组和免疫系统产生不同的效应。摄入诸如酸奶、泡菜等食物会导致机体总体微生物多样性增加,其中较大的食物摄入分量会产生更大的影响。本文研究提供了一个例子揭示了饮食中的简单改变或能重塑健康人群机体中的微生物菌群。
此外,在摄入发酵食物的参与者组中,四类免疫细胞也表现出了较少的活性,血液样本中所测定的19种炎性蛋白的水平也随之下降了。其中一种名为白介素6的特殊蛋白则与多种疾病发生直接相关,包括风湿性关节炎、2型糖尿病和慢性压力等。研究者Christopher Gardner说道,靶向微生物的饮食模式或能改变机体的免疫状态,从而就为健康人群降低机体的炎症水平提供了一定的帮助。这一研究发现在所有被分配到摄入高发酵食物的研究组中是一致的。
相比之下,被分配到摄入富含豆类、种子、全谷物等高纤维饮食中的参与者机体中的19种炎性蛋白的水平并未发生下降;平均而言,其机体肠道微生物菌群的多样性也能保持稳定;研究者推测,高纤维饮食会产生普遍的有益影响,并增加微生物菌群的多样性,相关研究数据表明,仅在短时间内增加膳食纤维的摄入量或许并不足以增加机体的微生物多样性。目前有大量研究证据表明,饮食能塑造机体肠道微生物组,从而影响机体免疫系统的功能和整体健康;而较低的微生物组多样性则与肥胖和糖尿病发生直接相关。
7.Cell:一种激活CaMKII的基因疗法可保护视网膜神经节细胞,阻止青光眼引起的视力下降
doi:10.1016/j.cell.2021.06.031
青光眼是造成视觉障碍和失明的主要原因。在一项新的研究中,来自美国西奈山伊坎医学院等研究机构的研究人员发现在一种青光眼小鼠模型中,一种基因疗法能保护视神经细胞并保存视力。这一发现为开发针对青光眼的神经保护疗法提供了一条道路。相关研究结果于2021年7月22日在线发表在Cell期刊上,论文标题为“Preservation of vision after CaMKII-mediated protection of retinal ganglion cells”。
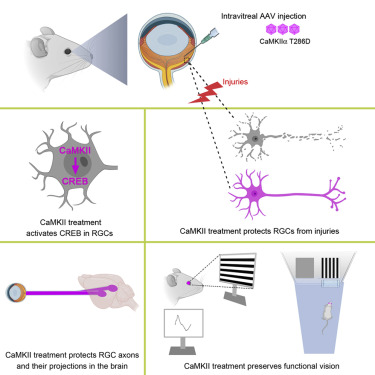
利用基因疗法阻止青光眼引起的视力下降,图片来自Cell, 2021, doi:10.1016/j.cell.2021.06.031。
在寻找干预的方法时,他们发现用基因疗法激活CaMKII通路被证明对视网膜神经节细胞有保护作用。在遭受毒性刺激(对这些细胞造成快速损害)之前和遭受视神经挤压伤(造成较慢的损害)之后,对小鼠进行基因治疗,增加了CaMKII的活性,有力地保护了视网膜神经节细胞。在经过基因治疗的小鼠中,77%的视网膜神经节细胞在遭受毒性刺激(toxic insult)后12个月内存活,而对照组小鼠只有8%。在遭受视神经挤压伤6个月后,77%的视网膜神经节细胞存活,而对照组只有7%。同样,通过基因治疗提高CaMKII的活性被证明对基于眼压升高或基因缺陷的青光眼模型中的视网膜神经节细胞有保护作用。
8.Cell:揭示冗余模块化网络组织支持正常的大脑通信
doi:10.1016/j.cell.2021.05.026
回忆一个电话号码,或刚刚记住的路线,你的大脑将在许多区域之间积极沟通。人们认为,工作记忆(working memory)依赖于这些区域之间的互动,但这些大脑区域如何互动并正确表达记忆一直是个谜。在一项新的研究中,美国贝勒医学院神经科学助理教授Nuo Li博士和他的同事们调查了参与工作记忆的大脑区域之间的沟通性质,并发现有证据表明模块化网络组织(modular network organization)对于持久的神经活动至关重要。相关研究结果发表在2021年7月8日的Cell期刊上,论文标题为“Modularity and robustness of frontal cortical networks”。
Li和他的同事们能够观察到,大脑的每个半球对一段记忆都有各自的表征。然而,这些半球在每时每刻都是紧密协调的,导致在工作记忆期间它们之间的信息高度一致。这些作者让小鼠参与一种简单的要求它们储存特定信息的行为。它们接受的训练是针对指令的行动延迟几秒钟。这种时间延迟使得他们有机会观察记忆过程中的大脑活动。Li说,“我们观察到许多神经元同时从大脑皮层的两个半球以一种协调的方式放电。如果一个区域的活动上升,另一个区域也会紧随其后。我们假设大脑半球之间的相互作用是负责这些记忆的。”
Li和他的同事们记录了每个半球的活动,表明在记忆过程中每个半球都对信息进行了自己的复制。Li解释说,通过使用光遗传学,他们能够破坏单个半球的信息,这在记忆期间影响成千上万个神经元。他们的发现是出乎意料的。Li说,“当我们破坏一个半球时,另一个区域关闭了通信,基本上防止了这种破坏的扩散和影响其他区域的活动。这类似于现代网络,如电网。它们被连接起来,允许电力流动,但也会监测故障,在必要时关闭连接,以便整个电网不会瘫痪。”
在与斯坦福大学Shaul Druckmann博士和博士生Byungwoo Kang的合作下,Li和他的同事们对这一过程进行了理论分析和网络模拟,表明大脑中的这种模块化组织对于持续的神经活动的稳健性至关重要。这种稳健性可能是大脑能够承受某些伤害的原因,保护认知功能不受干扰。
9.Cell:表达GABA受体的小胶质细胞选择性重塑和修剪抑制性突触
doi:10.1016/j.cell.2021.06.018
大脑筛选这种无休止的信息流的非凡能力是由数十亿个突触组成的复杂的神经网络所实现的,突触是调节细胞之间信号传输的特殊连接。这些连接有的抑制信号传输,有的加快信号传输--这是以毫秒为单位的平衡行为,确保我们的大脑以最高效率运作。如今,在一项新的研究中,来自美国哈佛医学院、麻省理工学院和布罗德研究所的研究人员发现这种抑制和兴奋之间的微妙平衡至少部分是由高度专业化的小胶质细胞亚群---大脑的常驻免疫细胞---维持的,它们在抵抗感染和清理细胞碎片方面的作用是众所周知的。 这项研究在小鼠身上进行,首次揭示了这群特殊的免疫细胞能够精细地检测抑制性突触并专门与抑制性突触(即减缓细胞间信息流动的连接)接触。相关研究结果于2021年7月6日在线发表在Cell期刊上,论文标题为“GABA-receptive microglia selectively sculpt developing inhibitory circuits”。
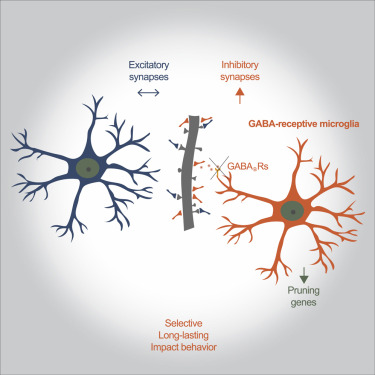
图片来自Cell, 2021, doi:10.1016/j.cell.2021.06.018。
此外,这项研究还显示,这些细胞通过直接的身体接触与抑制性突触相互作用,这是先进的成像技术使得这些作者能够实时观察小鼠大脑中的细胞如何相互作用的首次观察。
这些实验表明,这种接触是通过位于小胶质细胞表面的GABA受体发生的,并使这些细胞与释放GABA的抑制性突触精确接触。GABA是大脑的主要抑制性神经递质,对细胞间的信号传递起着制动作用。这项研究显示,GABA似乎作为一种引诱信号作用于特定的小胶质细胞亚群,邀请这些细胞尽情享用释放GABA的抑制性突触。
10.Cell:揭示烟酰胺核苷酸转氢酶调节皮肤色素沉着新机制,有望开发出预防皮肤癌的新疗法
doi:10.1016/j.cell.2021.06.022
在一项新的研究中,来自美国麻省总医院的研究人员发现了一种皮肤色素沉着机制,这种皮肤色素沉着机制可以使人类的皮肤颜色变深,从而抵御与紫外线有关的癌症。调节这一生物过程的是一种称为烟酰胺核苷酸转氢酶(nicotinamide nucleotide transhydrogenase, NNT)的酶,它在黑色素(一种保护皮肤免受有害紫外线伤害的色素)的产生中起着关键作用,通过外用药物或药膏对其进行抑制可能会降低皮肤癌的风险。相关研究结果于2021年7月6日在线发表在Cell期刊上,论文标题为“NNT mediates redox-dependent pigmentation via a UVB- and MITF-independent mechanism”。
通过对人类和动物模型皮肤的实验室工作,这些作者模拟了存在于深色色素的人身上的自然保护。在这个过程中,他们对所涉及的生化机制及其驱动因素以及它们如何被一种独立于紫外线辐射、阳光照射或遗传的外用制剂所影响有了更全面的了解。
Fisher解释说,“我们曾假设,通过氧化黑色素体(细胞的合成和储存区室)中的氨基酸酪氨酸来制造黑色素的酶在很大程度上受到基因表达的调节。”然而,他们惊讶地发现,所产生黑色素的数量在很大程度上是由一个非常不同的化学机制调节的,这个机制最终可以追溯到线粒体中的一种酶,它具有改变皮肤色素沉着的能力。
这些作者发现,NNT的小分子抑制剂的局部施用导致人类皮肤变黑,而NNT功能下降的小鼠显示出毛皮色素沉着增加。为了检验他们的发现,他们让皮肤进行了紫外线辐射,发现具有较深色素的皮肤确实受到了保护,免受紫外线造成的DNA损伤。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


