用生命“赌”病因,全基因组测序是否能终结求医苦旅?
来源:生物谷原创 2021-07-22 18:13
世界上有近7000种罕见病,约80%罕见病是源于基因缺陷导致的遗传病。但由于人类基因组含有约30亿对碱基对,造成由基因缺陷导致的罕见病不仅种类繁多,还很少见,大部分医生们很难有相关诊断经验,导致罕见病人的诊断之路充满迷雾般的坎坷。有数据显示,全球每个罕见病患者平均看过8个医生、有过3次误诊经历、平均确诊时间长达7年多。
世界上有近7000种罕见病,约80%罕见病是源于基因缺陷导致的遗传病。但由于人类基因组含有约30亿对碱基对,造成由基因缺陷导致的罕见病不仅种类繁多,还很少见,大部分医生们很难有相关诊断经验,导致罕见病人的诊断之路充满迷雾般的坎坷。有数据显示,全球每个罕见病患者平均看过8个医生、有过3次误诊经历、平均确诊时间长达7年多。

近年来,靶向测序和全基因组测序(WGS)得到广泛认可,逐渐成为辅助医生进行遗传病诊断的重要工具。7月17日,中国罕见病联盟指导、北京病痛挑战基金会主办的“2021第三届罕见病合作交流会”在北京举行,与会专家学者围绕“健康中国,一个都不能少”这一主题,共同为提高我国罕见病诊断、治疗、支付、服务水平建言献策。
正如国家儿童医学中心复旦大学附属儿科医院周文浩副院长所说,“遗传病的临床表现在疾病早期往往不典型,尤其是在危重症状态下的新生儿中可能尚未完全显现。危重症状态下的患儿遗传病表型还可能被其他临床症状所掩盖,给病因的诊断带来困难。而基因检测就像“百度地图”,带领我们探索疾病的真相。”
罕见病治疗成功的应用
人体生理机制比任何已知的机器都更为复杂。人类个体间的典型差异表现在,不同个体基因组之间具有数以百万的差异位点。在这些差异位点中,至少有上万个已经知道具有改变生理的潜在作用。基因组内核苷酸水平很小范围的变化,都可能造成紊乱,比如感染疾病,对药物处理的反应。考虑到患者个体间的差异,对疾病的诊断和治疗,都将依赖于对遗传信息的认知。
在测序技术的帮助下探究疾病和基因间的联系,仅仅只是第一步。2011年6月15日, 美国贝勒人类基因组测序中心和有关机构联合发布一份报告称, 贝勒大学医学院的研究人员及来自圣地亚哥和密歇根大学安娜堡分校的专家,通过对一对双胞胎及其家人进行全基因组测序和对比分析, 找到了引起这对患有多巴反应性肌张力障碍(Dopa-Responsive Dystonia)疾病的突变基因—SPR基因。
SPR基因编码的一种酶被认为和多巴反应性肌张力失常有关,可以促进两种神经递质的合成。该基因的发现使医生能够对病症进行针对性治疗, 并取得了显著的效果。这也是人类进入个体化医疗时代,全基因组测序在罕见病治疗上的一次成功的应用。
随着基因测序技术的发展,越来越多的研究证明,基因测序在罕见疾病诊断中扮演着重要角色。2020年6月25号,剑桥大学血液学系Willem H.Ouwehand教授团队在Nature上发表一项研究, 通过对13037名参与者进行WGS分析,其中9802名患有罕见疾病,并为7065个具有广泛表型参与者中的1138名提供了基因诊断,为罕见病治疗提供了基因诊断的基础。
研究者确定了 95 种基因与罕见疾病之间的孟德尔关联,其中 11 种自 2015 年以来已被发现,至少 79 种被证实是病因学。同时,确定了四种新的非编码变体,它们通过破坏 ARPC1B、GATA1、LRBA 和 MPL 的转录而引起疾病。因此,在常规医疗保健中使用 WGS 进行诊断和病因发现的协同作用。
因美纳大中华区市场总监王飚先生指出:“快速全基因组测序(WGS)是目前罕见病和遗传疾病诊断的重要手段之一,改变了全球众多罕见病患者及家庭的命运。罕见遗传疾病一直以来是因美纳全球乃至中国聚焦的重要领域,推动中国罕见病诊疗现状的不断改善,使得更多患者和家庭不再面临求医的苦旅,及早确诊,获得更好的诊疗方案。”
罕见病基因图谱的扩大
自从引入下一代测序技术以来,每年大约有100 多种新的疾病确定与基因相关。因此探索罕见病之间的关系有助于揭示相似罕见遗传病的共同属性。然而,从表型特征和分子机制等多个层面建立如此复杂和症状重叠的疾病之间的关系是罕见病实践中的一个重要挑战。罕见病的分类、表型特征、潜在遗传缺陷可以提高发现潜在致病机制的概率,最重要的是可以帮助罕见遗传病的临床诊断和改进治疗方案。
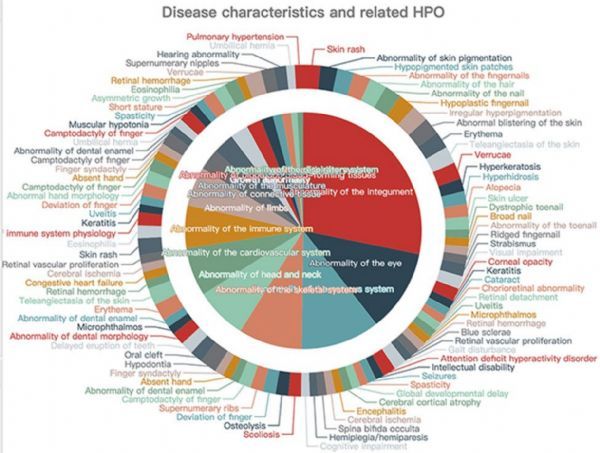
2021年,科学家基于Human Phenotype Ontology (HPO)和Gene Ontology (GO)计算了表型与致病基因之间的定量距离,并发布了RDmap 的罕见疾病地图,表型图谱共收录罕见病3287种,基因图谱收录罕见遗传病3789种,1718 种重叠疾病连接在两张地图之间。该图谱可帮助助临床医生和研究人员探索日益复杂的罕见遗传疾病领域。
随着科学界对于罕见疾病的广泛关注,二代测序技术逐渐用于检测罕见疾病的致病基因,且取得了显著成果。测序结果能够显示致病基因的位置及类型等重要信息。 其具有快速、高效、准确、经济以及 产出巨大等特点,对辅助诊断罕见病具有重要意义。
WGS为所需样本量少无需检测基因中的非编码序列,更加经济,不需要提前预测致病基因,更适用于诊断困难的罕见病患者。 WGS 检测对于多拷贝数变异、内含子变异、剪切位点突 变、单碱基变异的识别较其他基因测序技术更为有效,且WGS偏倚更小, 一致性更好,检测范围更广、速度更快,且通过简单的抽血采样就能完成 。
技术之外的障碍
就像所有新技术一样,基因检测也面临一些障碍。目前,WGS为罕见病患者提供了明显的诊断益处。然而,其广泛采用存在障碍,包括缺乏临床实践标准。
借此时机,由国家儿童医学中心/复旦大学附属儿科医院,因美纳联合主办了“纳罕”众智同心,探索真相会议,重磅发布了我国首个《危重新生儿遗传性疾病快速全基因组测序专家共识》(以下简称为《共识》)。该共识在国家儿童医学中心、复旦大学附属儿科医院等专家的指导下,汇集全国11家医院基于国内外最新的临床研究和临床实践编写,为基因测序助力儿童罕见病诊疗发展带来了新思路、新标准、新规范。

cedars-sinai.org
近年来,靶向测序和全基因组测序(WGS)得到广泛认可,逐渐成为辅助医生进行遗传病诊断的重要工具。7月17日,中国罕见病联盟指导、北京病痛挑战基金会主办的“2021第三届罕见病合作交流会”在北京举行,与会专家学者围绕“健康中国,一个都不能少”这一主题,共同为提高我国罕见病诊断、治疗、支付、服务水平建言献策。
正如国家儿童医学中心复旦大学附属儿科医院周文浩副院长所说,“遗传病的临床表现在疾病早期往往不典型,尤其是在危重症状态下的新生儿中可能尚未完全显现。危重症状态下的患儿遗传病表型还可能被其他临床症状所掩盖,给病因的诊断带来困难。而基因检测就像“百度地图”,带领我们探索疾病的真相。”
罕见病治疗成功的应用
人体生理机制比任何已知的机器都更为复杂。人类个体间的典型差异表现在,不同个体基因组之间具有数以百万的差异位点。在这些差异位点中,至少有上万个已经知道具有改变生理的潜在作用。基因组内核苷酸水平很小范围的变化,都可能造成紊乱,比如感染疾病,对药物处理的反应。考虑到患者个体间的差异,对疾病的诊断和治疗,都将依赖于对遗传信息的认知。
在测序技术的帮助下探究疾病和基因间的联系,仅仅只是第一步。2011年6月15日, 美国贝勒人类基因组测序中心和有关机构联合发布一份报告称, 贝勒大学医学院的研究人员及来自圣地亚哥和密歇根大学安娜堡分校的专家,通过对一对双胞胎及其家人进行全基因组测序和对比分析, 找到了引起这对患有多巴反应性肌张力障碍(Dopa-Responsive Dystonia)疾病的突变基因—SPR基因。
SPR基因编码的一种酶被认为和多巴反应性肌张力失常有关,可以促进两种神经递质的合成。该基因的发现使医生能够对病症进行针对性治疗, 并取得了显著的效果。这也是人类进入个体化医疗时代,全基因组测序在罕见病治疗上的一次成功的应用。
随着基因测序技术的发展,越来越多的研究证明,基因测序在罕见疾病诊断中扮演着重要角色。2020年6月25号,剑桥大学血液学系Willem H.Ouwehand教授团队在Nature上发表一项研究, 通过对13037名参与者进行WGS分析,其中9802名患有罕见疾病,并为7065个具有广泛表型参与者中的1138名提供了基因诊断,为罕见病治疗提供了基因诊断的基础。
研究者确定了 95 种基因与罕见疾病之间的孟德尔关联,其中 11 种自 2015 年以来已被发现,至少 79 种被证实是病因学。同时,确定了四种新的非编码变体,它们通过破坏 ARPC1B、GATA1、LRBA 和 MPL 的转录而引起疾病。因此,在常规医疗保健中使用 WGS 进行诊断和病因发现的协同作用。
因美纳大中华区市场总监王飚先生指出:“快速全基因组测序(WGS)是目前罕见病和遗传疾病诊断的重要手段之一,改变了全球众多罕见病患者及家庭的命运。罕见遗传疾病一直以来是因美纳全球乃至中国聚焦的重要领域,推动中国罕见病诊疗现状的不断改善,使得更多患者和家庭不再面临求医的苦旅,及早确诊,获得更好的诊疗方案。”
罕见病基因图谱的扩大
自从引入下一代测序技术以来,每年大约有100 多种新的疾病确定与基因相关。因此探索罕见病之间的关系有助于揭示相似罕见遗传病的共同属性。然而,从表型特征和分子机制等多个层面建立如此复杂和症状重叠的疾病之间的关系是罕见病实践中的一个重要挑战。罕见病的分类、表型特征、潜在遗传缺陷可以提高发现潜在致病机制的概率,最重要的是可以帮助罕见遗传病的临床诊断和改进治疗方案。
2021年,科学家基于Human Phenotype Ontology (HPO)和Gene Ontology (GO)计算了表型与致病基因之间的定量距离,并发布了RDmap 的罕见疾病地图,表型图谱共收录罕见病3287种,基因图谱收录罕见遗传病3789种,1718 种重叠疾病连接在两张地图之间。该图谱可帮助助临床医生和研究人员探索日益复杂的罕见遗传疾病领域。
罕见病地图疾病细节信息.https://ojrd.biomedcentral.com/articles/10.1186/s13023-021-01741-4
随着科学界对于罕见疾病的广泛关注,二代测序技术逐渐用于检测罕见疾病的致病基因,且取得了显著成果。测序结果能够显示致病基因的位置及类型等重要信息。 其具有快速、高效、准确、经济以及 产出巨大等特点,对辅助诊断罕见病具有重要意义。
WGS为所需样本量少无需检测基因中的非编码序列,更加经济,不需要提前预测致病基因,更适用于诊断困难的罕见病患者。 WGS 检测对于多拷贝数变异、内含子变异、剪切位点突 变、单碱基变异的识别较其他基因测序技术更为有效,且WGS偏倚更小, 一致性更好,检测范围更广、速度更快,且通过简单的抽血采样就能完成 。
技术之外的障碍
就像所有新技术一样,基因检测也面临一些障碍。目前,WGS为罕见病患者提供了明显的诊断益处。然而,其广泛采用存在障碍,包括缺乏临床实践标准。
借此时机,由国家儿童医学中心/复旦大学附属儿科医院,因美纳联合主办了“纳罕”众智同心,探索真相会议,重磅发布了我国首个《危重新生儿遗传性疾病快速全基因组测序专家共识》(以下简称为《共识》)。该共识在国家儿童医学中心、复旦大学附属儿科医院等专家的指导下,汇集全国11家医院基于国内外最新的临床研究和临床实践编写,为基因测序助力儿童罕见病诊疗发展带来了新思路、新标准、新规范。
《危重新生儿遗传性疾病快速全基因组测序专家共识》发布,从左至右:王飚先生,吴冰冰教授,罗飞宏教授,周文浩副院长,王达辉教授
该《共识》首次明确了快速全基因组测序的适用人群、实施流程、临床医生在基因测序过程中的具体工作、分子生物学实验室要求、基因检测数据分析等操作规范。这一共识的发布填补了国内的一个空白。
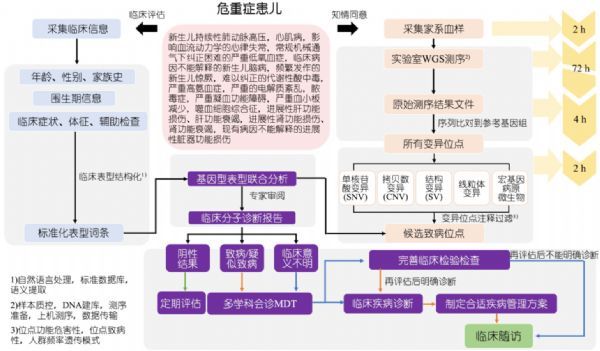
快速 WGS 测序应用于危重症新生儿病因诊断的关键点在于,能在最短时间内得到检测结果,为临床决策提供依据。 因此在整个检测实施流程中需要临床和实验室相互配合,做到无缝对接。 来自国家儿童医学中心复旦大学附属儿科医院分子医学中心副主任 吴冰冰教授强调,“常规的基因检测通常需要4-8周的时间,无法满足危重症新生儿的迅速明确诊断的需求,而快速全基因组测序,通过建立快速实施规范,可将检测至口头报告的时间缩短为7到10天,为临床实施精准治疗决策提供依据,改善患儿预后。”
当然,昂贵的成本也是面临的重大挑战。有数据估计,基因测序整个过程的价格大约在2万人民币。因此纳入检测的新生儿病例需要有选择性。未来随着测序成本的进 一步下降,WGS 测序在临床诊断中的应用有望进一步拓展。
同时,《共识》强调,报告解读和咨询,变异分析和解读需要由具有遗传咨 询医师资质或具备遗传咨询能力的医生完成,该医生需要 熟练掌握常见遗传病的发病机制、遗传模式、临床表现,能 对家系遗传病再发风险进行计算和评估,并给出临床指导 意见。发动 MDT 专家讨论,制定临床决策。
目前,我国遗传/罕见病检测仍处起步阶段,由于遗传疾病成因复杂,相关基因众多,涉及外显子、线粒体、非编码区等传统NGS检测覆盖较少的位点区域,要开发出罕见病诊断领域临床检出率高的产品,存在一定门槛。
罕见病人群健康是全民健康中不可分割的一部分。 伴随精准医疗概念的提出,基因治疗技术获得迅猛发展,开辟了诊断和治疗罕见病的新方法。产前诊断和新生儿筛查是预防和及早发现新生儿罕见遗传病的重要手段。 伴随着分子遗传学技术和细胞遗传学的发展和进步,尤其是人类基因组计划取得的瞩目成就,罕见病的诊疗也必将进入“精准医疗” 的时代。
参考资料
1.吕薇薇, 李施璇. 人类进入个体化医疗时代——全基因组测序支持治愈美国双胞胎多巴反应性肌张力障碍[J]. 遗传, 2011(07):112-115.
2.Bycroft,C. et al. The UK Biobank resource with deep phenotyping and genomic data. Nature 562, 203–209(2018)
3.危重新生儿遗传性疾病快速全基因组测序专家共识.DOI:10.3969 / j.issn.1673⁃5501.2020.05.001
4.Marshall C R , Bick D , Belmont J W , et al. The Medical Genome Initiative: Moving whole-genome sequencing for rare disease diagnosis to the clinic[J]. Genome Medicine, 2020, 12(1).
5.Yang J , Dong C , Duan H , et al. RDmap: A Map for Exploring Rare Diseases. 2020.
6.Turro E , Astle W J , Megy K , et al. Whole-genome sequencing of patients with rare diseases in a national health system[J]. Nature, 2020:1-9.
快速 WGS 测序应用于危重症新生儿病因诊断的关键点在于,能在最短时间内得到检测结果,为临床决策提供依据。 因此在整个检测实施流程中需要临床和实验室相互配合,做到无缝对接。 来自国家儿童医学中心复旦大学附属儿科医院分子医学中心副主任 吴冰冰教授强调,“常规的基因检测通常需要4-8周的时间,无法满足危重症新生儿的迅速明确诊断的需求,而快速全基因组测序,通过建立快速实施规范,可将检测至口头报告的时间缩短为7到10天,为临床实施精准治疗决策提供依据,改善患儿预后。”
快速 WGS 临床和实验室实施流程 .DOI:10.3969 / j.issn.1673⁃5501.2020.05.001
当然,昂贵的成本也是面临的重大挑战。有数据估计,基因测序整个过程的价格大约在2万人民币。因此纳入检测的新生儿病例需要有选择性。未来随着测序成本的进 一步下降,WGS 测序在临床诊断中的应用有望进一步拓展。
同时,《共识》强调,报告解读和咨询,变异分析和解读需要由具有遗传咨 询医师资质或具备遗传咨询能力的医生完成,该医生需要 熟练掌握常见遗传病的发病机制、遗传模式、临床表现,能 对家系遗传病再发风险进行计算和评估,并给出临床指导 意见。发动 MDT 专家讨论,制定临床决策。
目前,我国遗传/罕见病检测仍处起步阶段,由于遗传疾病成因复杂,相关基因众多,涉及外显子、线粒体、非编码区等传统NGS检测覆盖较少的位点区域,要开发出罕见病诊断领域临床检出率高的产品,存在一定门槛。
罕见病人群健康是全民健康中不可分割的一部分。 伴随精准医疗概念的提出,基因治疗技术获得迅猛发展,开辟了诊断和治疗罕见病的新方法。产前诊断和新生儿筛查是预防和及早发现新生儿罕见遗传病的重要手段。 伴随着分子遗传学技术和细胞遗传学的发展和进步,尤其是人类基因组计划取得的瞩目成就,罕见病的诊疗也必将进入“精准医疗” 的时代。
参考资料
1.吕薇薇, 李施璇. 人类进入个体化医疗时代——全基因组测序支持治愈美国双胞胎多巴反应性肌张力障碍[J]. 遗传, 2011(07):112-115.
2.Bycroft,C. et al. The UK Biobank resource with deep phenotyping and genomic data. Nature 562, 203–209(2018)
3.危重新生儿遗传性疾病快速全基因组测序专家共识.DOI:10.3969 / j.issn.1673⁃5501.2020.05.001
4.Marshall C R , Bick D , Belmont J W , et al. The Medical Genome Initiative: Moving whole-genome sequencing for rare disease diagnosis to the clinic[J]. Genome Medicine, 2020, 12(1).
5.Yang J , Dong C , Duan H , et al. RDmap: A Map for Exploring Rare Diseases. 2020.
6.Turro E , Astle W J , Megy K , et al. Whole-genome sequencing of patients with rare diseases in a national health system[J]. Nature, 2020:1-9.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->