肿瘤来源的外泌体在树突状细胞分化、成熟和功能改变中的作用
来源:本站原创 2021-06-11 09:48
近日,伊朗的伊斯法罕医科大学研究者在Molecular Cancer杂志上发表了题为"The roles of tumor-derived exosomes in altered differentiation, maturation and function of dendritic cells"的文章。肿瘤来源的外泌体(TDEs)已被证明通过其免疫抑制货
近日,伊朗的伊斯法罕医科大学研究者在Molecular Cancer杂志上发表了题为"The roles of tumor-derived exosomes in altered differentiation, maturation and function of dendritic cells"的文章。肿瘤来源的外泌体(TDEs)已被证明通过其免疫抑制货物来阻碍抗肿瘤免疫反应。由于树突状细胞(DC)是启动和维持T细胞介导的反应的关键介质,因此肿瘤细胞释放的外泌体对DC生物学起主导作用是合乎逻辑的。本论文旨在为肿瘤背景下TDES介导的树突状细胞异常提供一个机械性的洞察力。更重要的是,作者在不同的切片上广泛讨论了肿瘤外泌体如何诱导DC分化、成熟和功能的颠覆。作者还简要描述了TDEs在治疗水平上的重要性,以帮助指导未来的治疗选择,特别是基于DC的疫苗接种策略,并回顾了外泌体抑制剂的设计和发现方面的进展。了解胞外体的内容和TDEs导致免疫逃避的途径可能有助于修订治疗原理和设计新的治疗方法来克服癌症治疗中的障碍。
图片来源:https://doi.org/10.1186/s12943-021-01376-w
胞外体是纳米大小(30-150 nm)的胞外囊泡,几乎由所有类型的细胞释放,它们的内容强烈地反映了亲本细胞的内容。特别是,肿瘤细胞被显示活跃地分泌大量的外泌体,以提供与周围和远端细胞的细胞间通讯。这些胞外小泡含有几种类型的mrna、microrna、功能性表面蛋白、酶和脂类,使它们能够通过直接与细胞表面受体相互作用或通过质膜融合、内吞、吞噬、微吞饮和脂筏介导的内化将其内容转移到受体细胞中而发挥局部或全身效应。令人信服的证据表明,肿瘤衍生的外泌体(TDEs)有助于肿瘤的进展,并且在肿瘤发展的几乎所有方面都起着至关重要的作用,如血管生成、增殖和转移。
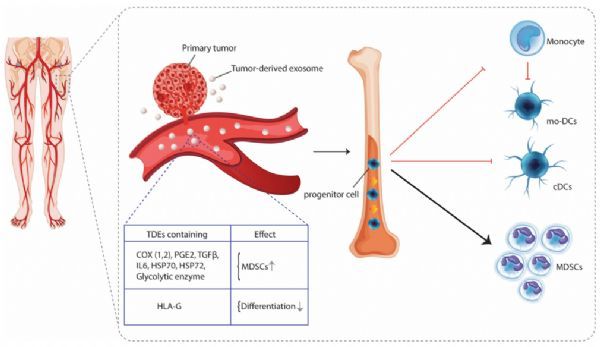
此外,TDES还通过负向调节抗癌免疫反应而促进肿瘤生长。一些研究表明,TDEs可以通过靶细胞内化或通过受体配体相互作用来抑制抗肿瘤免疫。在这方面,人们已经认识到,TDEs含有过多的膜结合蛋白(Fas-L,PD-L1等)能直接抑制效应CD8+T细胞和NK细胞的抗肿瘤活性。另一方面,更重要的是,肿瘤细胞释放的外泌体也可以被抗原呈递细胞(APCs)吸收或相互作用,从而间接诱导抗原特异性耐受。特别值得注意的是,TDEs特别针对树突状细胞(DC),这是最重要和最有效的APC,通过启动初始T细胞并提供效应器T细胞活动所需的后续信号来协调免疫反应。在这方面,研究表明,TDEs在很大程度上抑制了DC向骨髓祖细胞和单核细胞的分化,而强烈地促进了肿瘤支持细胞的发展,如髓系来源的抑制细胞(Mdscs)。肿瘤来源的外泌体还携带几个生物活性分子,这些分子可以干扰树突状细胞的成熟,从而破坏它们诱导有效的抗肿瘤反应的能力。此外,也有研究表明,TDEs可以改变分化良好的成熟DC的功能。根据已发表的数据,成熟的DC与TDEs的相互作用/摄取使其呈现免疫抑制表型,从而可以改善肿瘤的免疫逃逸。
相反,由于TDEs含有多种肿瘤相关抗原,人们普遍认为癌细胞释放的外泌体可以刺激DC,以支持强大的抗肿瘤免疫发展。然而,越来越多的证据表明,TDEs的主要作用是免疫抑制,而不是免疫刺激。综上所述,TDES似乎对作为免疫反应的关键介质的DC产生负面影响,从而阻止有效的抗肿瘤免疫的形成。然而,关于肿瘤来源的外泌体干扰树突状细胞生物学的分子机制的文献综述仍然缺乏。因此,在本研究中,作者提供了TDEs如何损害DC的分化、成熟和功能的公开证据。然后,作者简要讨论了从TDEs介导的DC异常中吸取的将研究转化为实践的经验教训,并综述了外泌体抑制剂作为潜在的癌症辅助治疗的设计和开发的进展。
肿瘤来源的外泌体抑制树突状细胞的分化
图片来源:https://doi.org/10.1186/s12943-021-01376-w
本文综述的文献表明,TDEs损害DC的分化、成熟和功能,有利于免疫逃逸和肿瘤生长。虽然本文讨论了肿瘤外泌体对DC生物学抑制作用的几种明确的、已证实的机制,但TDES也可能通过一些推测机制改变DC的行为。例如,阻断树突状细胞的分化主要归因于肿瘤来源的血管内皮生长因子(VEGF)的存在,其水平与人类癌症循环中树突状细胞的数量和TME呈负相关。肿瘤来源的外泌体也被证明通过将miRNA21转移到受体细胞来诱导VEGF的释放,从而导致肿瘤内VEGF水平的增加。最近的研究结果还表明,TDES含有一种活性的VEGF亚型,它与肿瘤生长和对普通单克隆抗体(MAb)治疗的耐药性有关。此外,肿瘤细胞还分泌过多的神经节苷脂GD2和GM3,抑制DC向CD34+和单核细胞前体分化,并诱导单核细胞来源的DC凋亡。这些含唾液酸鞘糖脂也被证明是通过外泌体从肿瘤中脱落的,并能主动抑制免疫细胞。因此,可以推测,其他几种胞外体生物分子,包括但不限于VEGF、miRNA-21和神经节苷脂,可能在肿瘤背景下的DC分化障碍中发挥作用;然而,它们的作用还有待研究。此外,据报道,肿瘤外泌体也含有显着数量的IL-10。高水平的IL-10通过下调MHC-I和共刺激分子的表达,阻断T细胞反应的启动,从而抑制DC的成熟。然而,到目前为止,还没有证据表明IL-10在TDES介导的DC缺陷中起作用。未来的研究可以阐明上述外体标记物与癌症中DC异常之间的联系。此外,由于不同的DC亚群表现出不同的表型特征和功能潜力,因此在未来的研究中,更多地关注TDES对DC亚群的影响将是非常重要的。此外,正如这篇综述后面讨论的那样,到目前为止,已经做出了很大努力来靶向外泌体或外泌体标记来抑制肿瘤进展和提高抗肿瘤免疫力。然而,尽管近年来在发现外泌体抑制剂方面取得了重大进展,但它仍处于初级阶段,这些抑制剂作为癌症辅助治疗的治疗价值尚未得到充分验证。大多数被测试的抑制外泌体的化合物都具有高度的细胞毒性,并且没有显示出抑制肿瘤外泌体的选择性,因此可能会通过抑制非肿瘤细胞的外泌体分泌而干扰细胞间的通讯,导致不想要的不良副作用。因此,在寻找选择性抑制或去除肿瘤外泌体的新化合物和可行靶点方面仍然存在重大挑战。总之,越来越多的证据支持这样的观点,即肿瘤来源的外泌体是包括DC在内的免疫细胞的潜在抑制因子,靶向这些细胞外小泡可能为更好地治疗癌症提供一条新的途径。(生物谷 Bioon.com)
参考资料
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->