研究揭示肿瘤相关巨噬细胞调控CD8+ T细胞命运新机制
来源:北京基因组所 2021-05-25 12:27
肿瘤免疫治疗为癌症患者带来新的治疗手段和希望,在多种肿瘤类型中得到了成功应用。一部分病人可以响应免疫治疗并取得理想的治疗效果,但大部分病人对免疫治疗无法产生响应。其中一个重要原因是其肿瘤微环境中T细胞的功能已经处于不可逆的失调状态。研究表明,肿瘤相关巨噬细胞是诱导T细胞功能失调的主力军之一。作为免疫细胞的一员,巨噬细胞进入肿瘤微环境中
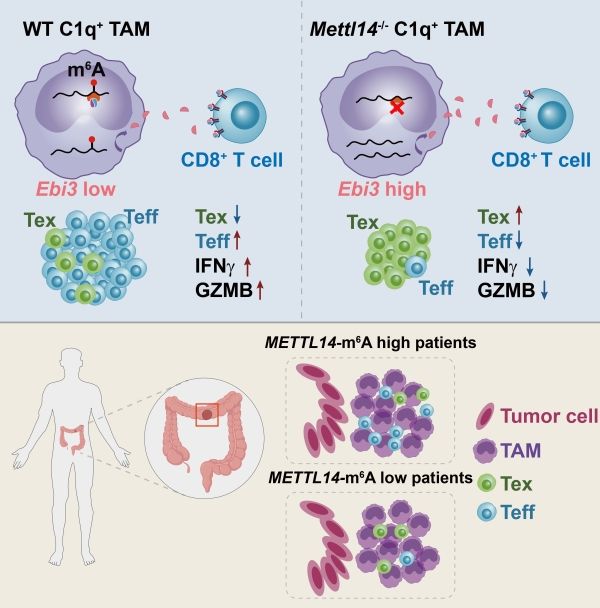
肿瘤免疫治疗为癌症患者带来新的治疗手段和希望,在多种肿瘤类型中得到了成功应用。一部分病人可以响应免疫治疗并取得理想的治疗效果,但大部分病人对免疫治疗无法产生响应。其中一个重要原因是其肿瘤微环境中T细胞的功能已经处于不可逆的失调状态。研究表明,肿瘤相关巨噬细胞是诱导T细胞功能失调的主力军之一。作为免疫细胞的一员,巨噬细胞进入肿瘤微环境中后往往受到肿瘤的影响,转变为促进肿瘤生长并抑制T细胞功能的状态,但其调控机制尚不清晰。作为真核细胞中mRNA上丰度最高的修饰类型,m6A修饰可通过影响mRNA的稳定性及翻译效率等过程对细胞功能进行精确调控。但近期的工作也发现,m6A修饰系统在多种类型肿瘤中处于失调状态。那么,m6A修饰失调是否影响肿瘤相关巨噬细胞的功能,并参与其对T细胞功能的调控呢?
中国科学院北京基因组研究所(国家生物信息中心)研究员韩大力课题组联合清华大学免疫研究所研究员徐萌团队,在Cancer Cell上,发表题为The loss of RNA N6-adenosine methyltransferase Mettl14 in tumor-associated macrophages promotes CD8+ T cell dysfunction and tumor growth的研究论文,揭示了特定肿瘤相关巨噬细胞亚群通过表观转录组层面调控CD8+ T细胞功能的新机制:m6A甲基化酶METTL14在C1q+巨噬细胞中的丧失,导致巨噬细胞中Ebi3转录本上m6A修饰的降低和EBI3表达量的增加,进而诱导肿瘤浸润的CD8+ T细胞的功能失调。
研究发现,肿瘤相关巨噬细胞中存在一类C1q+巨噬细胞亚群,通过表面的免疫调节受体和T细胞相互作用。C1q+巨噬细胞亚群中富集和m6A修饰相关的基因(如Mettl14)。进一步探究m6A修饰在巨噬细胞中的作用,研究人员发现,在巨噬细胞中特异性敲除Mettl14的小鼠抗肿瘤能力低于野生型小鼠,肿瘤浸润的CD8+ T细胞比例显着下降。单细胞测序数据表明,与野生型对照组相比,巨噬细胞中Mettl14的缺失可导致免疫微环境中浸润的效应性CD8+ T细胞和耗竭性T细胞前体细胞显着减少,而活化异常且功能失调的中间态CD8+ T细胞显着增多。功能验证进一步说明,巨噬细胞中Mettl14的缺失导致CD8+ T细胞的杀伤性功能下降,并且上调表达共抑制性受体。这些结果说明,Mettl14缺失的巨噬细胞打破了CD8+ T细胞分化的平衡,即抑制效应性CD8+ T细胞的活化而促使CD8+ T细胞功能失调。
通过整合分析野生型和Mettl14缺失的肿瘤相关巨噬细胞的m6A-seq和RNA-seq数据,发现Ebi3 mRNA上的m6A修饰水平在Mettl14缺失的巨噬细胞中显着降低,Ebi3 mRNA水平和蛋白表达水平显着提高。EBI3中和抗体通过挽救Mettl14条件性敲除小鼠中CD8+ T细胞的杀伤性功能,显着提高其抗肿瘤能力。结果表明,Mettl14缺失的巨噬细胞通过提高EBI3的表达量诱导CD8+ T细胞功能失调。为了探究上述结论是否适用于病人肿瘤样本,研究人员首先使用多色免疫组织化学染色技术,发现结肠癌病人的肿瘤样本中巨噬细胞与CD8+ T细胞的临近位置关系。此外,肿瘤基质中METTL14的表达量与m6A修饰水平及CD8+ T细胞的浸润呈正相关关系。肿瘤基质的m6A修饰水平高的病人与m6A修饰水平低的病人相比,肿瘤基质中浸润的CD8+ T细胞效应性功能更好。
综上,该研究报道了肿瘤相关巨噬细胞中RNA m6A修饰的失调导致EBI3表达量的上调,促使CD8+ T细胞功能失调的新机制。研究表明,m6A修饰在表观转录层面调控巨噬细胞的免疫调节功能,强调了巨噬细胞功能可塑性可通过表观转录动态变化实现精准调控。研究人员提出,靶向Mettl14下游抑制CD8+ T细胞功能的分子(如EBI3),有望恢复CD8+ T细胞功能并提高现有PD-1/PD-L1阻断抗体疗法的响应率。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


