胰腺癌新靶点SLC7A11:突破胰腺癌防御堡垒“潜力军”
来源:医药魔方 2021-05-18 12:31
众所周知,胰腺癌的治疗很困难,因为肿瘤周围有密集的纤维化组织,这些组织就像一个“堡垒”,阻碍了化疗药物的递送。过去40年来,胰腺癌的生存率几乎没有改善,如果不立即采取行动,预计到2025年,它将成为世界第二大癌症杀手。近期,新南威尔士大学的医学研究人员发现了一种方法,既能打击胰腺癌细胞,又能破坏那些阻碍治疗有效进行的细胞。他们的临床前
众所周知,胰腺癌的治疗很困难,因为肿瘤周围有密集的纤维化组织,这些组织就像一个“堡垒”,阻碍了化疗药物的递送。过去40年来,胰腺癌的生存率几乎没有改善,如果不立即采取行动,预计到2025年,它将成为世界第二大癌症杀手。
近期,新南威尔士大学的医学研究人员发现了一种方法,既能打击胰腺癌细胞,又能破坏那些阻碍治疗有效进行的细胞。他们的临床前研究已经进行了10年,接下来即将开展人体临床试验,相关研究结果发表在美国癌症研究协会的Cancer Research上。
领导这项研究的新南威尔士大学Phoebe Phillips副教授说:“胰腺癌周围的纤维化组织是由关键的‘辅助细胞’,也被称为癌症相关成纤维细胞(cancer associated fibroblast, CAF )产生的,癌细胞招募这些CAF来支持它们的生长和扩散。然而,这些辅助细胞在当前的治疗策略中被忽视了。我们的方法同时打击肿瘤细胞和CAF,因此是克服疾病侵袭性和耐药性的理想方法。”
在这篇文章中,研究小组展示了他们通过靶向一种被称为SLC7A11的转运蛋白来重组CAF代谢的新方法,它能切断细胞的促瘤活性,减少它们产生的纤维组织。
SLC7A11为溶质载体家族成员之一,该基因编码胱氨酸/谷氨酸反转运体Xc-系统的轻链亚基 SLC7A11(又称 xCT)。通过介导胱氨酸摄取和谷氨酸释放促进谷胱甘肽的合成,保护细胞免受氧化应激,维持细胞的氧化还原平衡,阻止脂质过氧化诱导的细胞死亡。SLC7A11在多种恶性肿瘤中过表达,与乳腺癌、卵巢癌、肝癌和肺癌等恶性肿瘤的生长、预后、转移和治疗密切相关。
“我们发现在胰腺癌小鼠模型上去除SLC7A11可以直接杀死胰腺癌细胞,减少肿瘤细胞在全身的扩散,并能减少纤维组织堡垒。”该研究的第一作者George Sharbeen博士说道。
综合模型,深入研究
SLC7A11先前在胰腺癌细胞中已有研究,并被确定为胰腺癌细胞的潜在靶点,但这是第一个表明它在肿瘤辅助细胞中也起关键作用的研究。“换句话说,我们已经发现了一种新的‘双细胞’治疗靶点,它既能对付肿瘤细胞,也能对付肿瘤细胞的助手,克服了目前标准化疗的局限性。”研究人员说道。
研究小组使用了几种互补的模型来提高他们发现的临床转化性,包括患者来源的胰腺癌细胞系和辅助细胞、包含人胰腺肿瘤组织移植模型的3D模型,以及多个胰腺癌小鼠模型。
首先,研究表明了SLC7A11在人胰腺癌CAF(而非肿瘤细胞)中的高表达,是总生存率低的独立预后因素。
为了评估SLC7A11在CAF中的功能,研究人员使用siRNA和两种药物抑制剂【柳氮磺吡啶(SSZ)及Erastin】来抑制SLC7A11。结果显示无论表达水平如何,SLC7A11在CAF中都是功能必需的。抑制CAF中的SLC7A11减少了CAF增生。
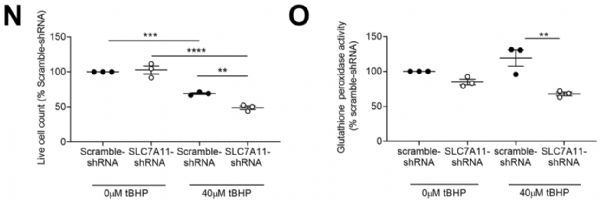
此外,抑制SLC7A11还让胰腺癌细胞对氧化应激和铁死亡(一种由脂质过氧化诱导且依赖于细胞内铁元素的独特细胞死亡形式)更为敏感。CAF中稳定的SLC7A11敲除降低了氧化应激下的细胞活力(下图N),增加了铁死亡(如谷胱甘肽过氧化物酶活性降低,下图O)。
接着,为了确定CAF中SLC7A11的抑制是否影响其支持PDAC细胞生长的能力,研究人员又进行了体外3D共培养实验。结果发现单独CAF或两种细胞中SLC7A11的敲除比单独胰腺癌细胞中SLC7A11敲除更能有效地抑制球体生长。
以上数据提示,CAF的存在可能会影响SLC7A11抑制在体内的作用,两个胰腺癌转基因小鼠模型被进一步用于评估SLC7A11基因消融的影响。实验结果与体外实验数据一致:仅胰腺癌细胞中SLC7A11的基因消融对肿瘤生长没有影响,SLC7A11在人胰腺癌细胞以及CAF中的稳定敲除是减少肿瘤生长、转移扩散和纤维化所必需的。
老药新用,加快临床转化
Phillips 副教授说:“接下来,我们将利用一种已知能有效抑制SLC7A11的抗关节炎药物——柳氮磺吡啶,用于治疗具有高SLC7A11水平肿瘤的胰腺癌患者(超一半的患者都有这种情况)。它具有改善治疗应答的潜力,并最终提高这些患者的生存率。”
他表示,使用一种批准的药物,能够更快地将其投入临床,而不用从零开始进行药物开发。
“除了使用‘老药’,我们还利用与新南威尔士大学教授Cyrille Boyer和昆士兰大学教授Thomas Davis进行多学科合作开发的尖端纳米药物,提供抑制SLC7A11的基因疗法。这种疗法是有优势的,因为我们的纳米药物很小,能够穿透胰腺癌的纤维组织堡垒。”该研究的共同一作Joshua McCarroll 副教授说。
总之,这项发现为Phillips副教授和David Goldstein教授领导的临床试验打下基础。除了临床试验之外,研究小组还希望评估他们的方法是如何干扰肿瘤细胞和辅助细胞之间的营养物质交换的,并希望找到理想的药物能与他们的治疗方法相结合,以增强抗肿瘤的效果。
胰腺癌是一种致死率很高的疾病,只有十分之一的患者能存活五年以上。“显然,我们需要改进治疗方法来扭转这些令人沮丧的统计数字,希望我们研究结果的临床转化最终能增加胰腺癌幸存者的数量。”Phillips副教授总结道。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。