Hepatology:癌症相关成纤维细胞通过CLCF1−CXCL6/TGF-β信号轴介导细胞通讯交流来促进肝细胞癌进展
来源:本站原创 2021-05-06 15:44
癌症相关成纤维细胞(Cancer-Associated Fibroblast)通过CLCF1−CXCL6/TGF-β信号轴介导肿瘤相关中性粒细胞、肿瘤细胞通讯交流来促进肝细胞癌进展。这些结果可能支持CLCF1级联作为一个潜在的预后生物标志物,并提示选择性阻断CLCF1/CNFR或ERK1/2信号通路可能为HCC患者提供一个有效的治疗策略
2021年5月6日讯/生物谷BIOON/---癌症相关成纤维细胞(CAFs, cancer-associated fibroblasts)是肿瘤微环境(TME, tumor microenvironment)中的重要细胞组分,也是导致肝细胞癌(HCC)发病的关键因素。然而,CAFs与TME中其他细胞组分之间的通讯交流模式和机制尚不明确。来自中山大学的夏建川课题组在Hepatology杂志上发文研究探讨了肝癌发病的不同阶段,CAFs、肿瘤细胞和肿瘤相关中性粒细胞(TANs, tumor-associated neutrophils)之间的细胞通讯交流。
80%以上的肝细胞癌存在的特征是由成纤维细胞的活化、增殖和积累引起的广泛肝纤维化。CAFs作为肝癌TME的一个重要群体,已被广泛报道影响肝癌的进展。而肝癌CAFs靶向治疗受到越来越多的关注。因此,更好地了解CAFs在HCC进展中的独特病理功能,将有助于开发更有效的靶向治疗。
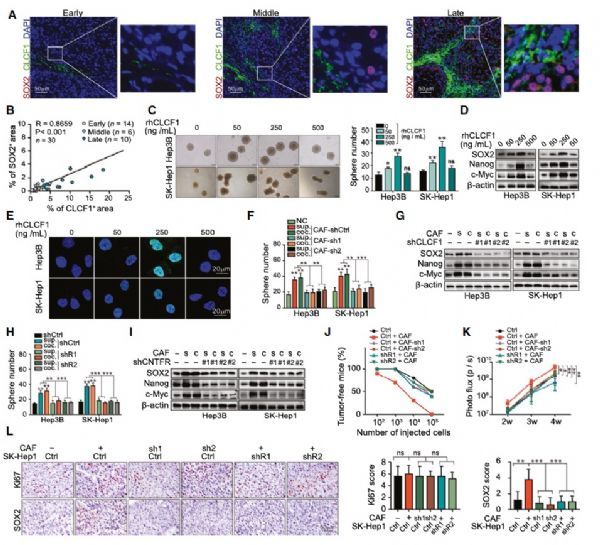
作者首先分离了不同分期的HCC患者样本中原代CAFs和配对的正常纤维细胞(NFs),基因表达谱分析显示CAF相关的标签基因群在CAFs中明显上调,其中细胞因子CLCF1上调最为明显,而且随着HCC分期恶化表达量明显增加。在HCC组织和血清中有高水平CLCF1表达的患者的总生存期(OS)和无进展生存期(PFS)均较差。表明CAF分泌的CLCF1可能在肝癌进展过程中发挥重要作用。
CAF分泌的CLCF1与HCC患者的低生存率密切相关
进一步作者发现CLCF1与干细胞干性基因SOX2有着正相关共表达,暗示CLCF1可能调控干细胞的干性维持。在不表达CLCF1的肝癌细胞系Hep3B和SKHep1中加入重组CLCF1蛋白或者CAF上清均可以增加干细胞特性。在CAF中敲低CLCF1或者在HCC细胞中敲低CLCF1的受体CNTFR均可以抑制该过程,这一发现也在NOD/SCID小鼠模型中得到了验证。表明CAF来源的CLCF1可以通过增强肿瘤干细胞的干性来促进肝癌进展。
CLCF1通过与其受体CNTFR相互作用,增强了HCC细胞的自我更新能力
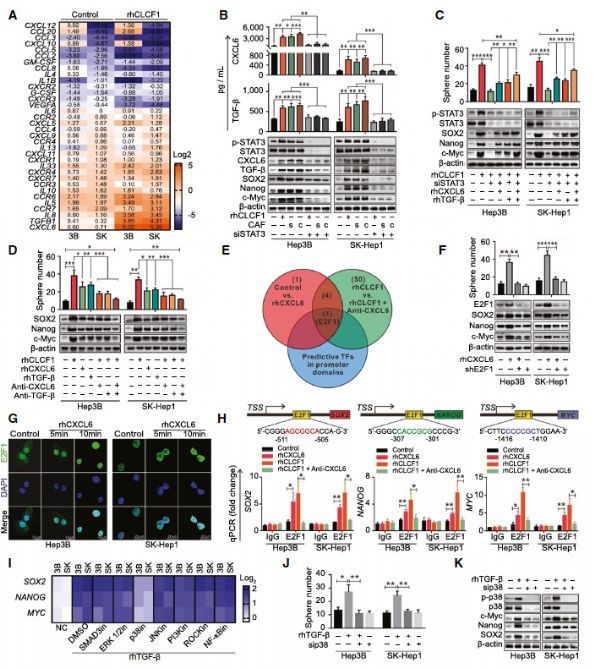
后续作者发现细胞因子CLCF1可以通过激活STAT3通路促进HCC中CXCL6和TGF-β的表达,敲低STAT3可以抵消CLCF1介导的干性增强。下游通路研究发现,一方面自分泌CXCL6通过上调E2F1表达进而促进下游SOX2, NANOG, MYC等基因表达促进HCC干性,另一方面自分泌TGF-β通过p38通路参与HCC干性维持。
STAT3-CXCL6/TGF-β通路是CLCF1介导的HCC细胞干性的部分原因
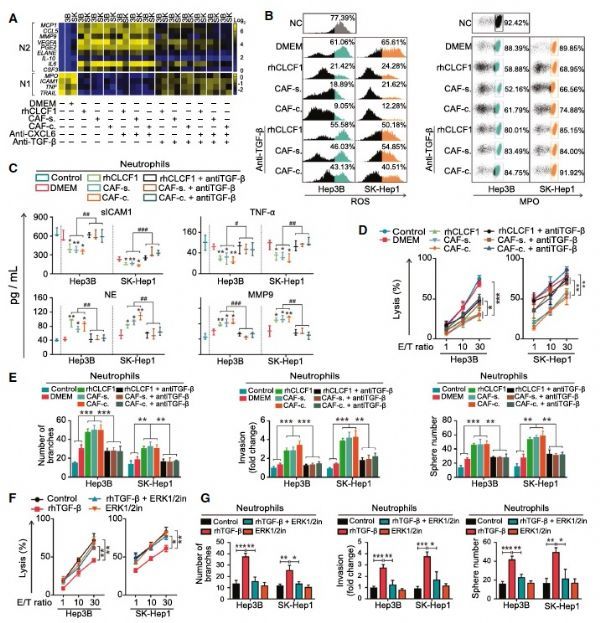
那HCC细胞中发生的变化是否对周围免疫细胞有影响呢,作者进一步发现HCC中增加的CXCL6和TGF-β以旁分泌方式分别招募中性粒细胞以及促进其“促肿瘤”的N2极化。
CLCF1诱导HCC细胞分泌的CXCL6和TGF-β协同诱导中性粒细胞“N2”极化
有趣的是,经CAFs诱导的HCC细胞可以通过CXCL6和TGF-β激活CAFs中的ERK1/2信号,促进CLCF1的产生,从而形成正反馈回路,加速HCC干性和中性粒细胞“N2”极化的诱导。最后作者分别在小鼠模型和人肝癌样本中对上述通路进行了验证,证明其保守性。
综上,作者发现在HCC的TME中,CAF来源的CLCF1(分泌形式不清楚)可以促进肿瘤细胞分泌更多的CXCL6以及TGF-β。CXCL6和TGF-β一方面以自分泌形式促进肿瘤细胞的干性,另一方面以旁分泌形式招募中性粒细胞并诱导其“N2”极化。同时CXCL6和TGF-β可以激活CAF中ERK1/2通路促进CLCF1本身的表达,形成正反馈。抑制ERK1/2或者CLCF1/CNTFR可以干扰CAF、肿瘤细胞和TAN的交流通讯。重要的是,在临床样本中,CLCF1−CXCL6/TGF-β轴的上调显示出与肿瘤干细胞增加、“N2”极化TAN、肿瘤分期和不良预后显著相关。这些结果暗示CLCF1可能是一个潜在的预后生物标志物,并提示选择性阻断CLCF1/CNTFR或ERK1/2信号可能为HCC患者提供一个有效的治疗靶点。
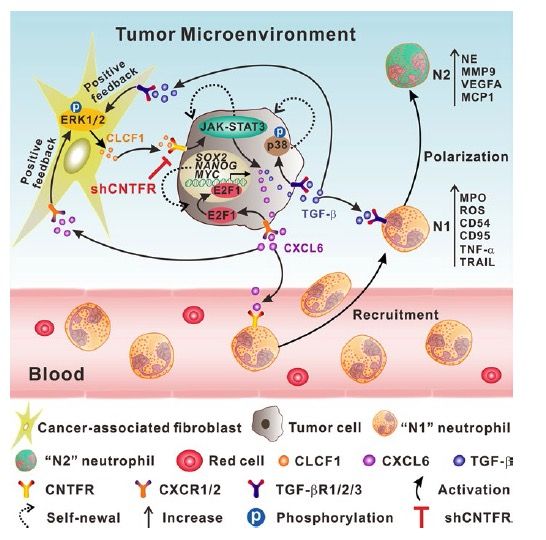
文章模式图
原始出处:Song M et al., Cancer-Associated Fibroblast-Mediated Cellular Crosstalk Supports Hepatocellular Carcinoma Progression. Hepatology. 2021 May;73(5):1717-1735. doi: 10.1002/hep.31792. PMID: 33682185.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->