Cell Research:我国科学家揭示甲型流感病毒感染可促进新冠病毒感染
来源:本站原创 2021-04-28 15:18
2021年4月28日讯/生物谷BIOON/---新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。截至2021年4月28日,全球已有超过1.48亿例确诊感染病例,312万人死亡(https://origin-coronavirus.jhu.edu/map.html)。目前COVID-19大流行浪潮的结束时间和最终
2021年4月28日讯/生物谷BIOON/---新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。截至2021年4月28日,全球已有超过1.48亿例确诊感染病例,312万人死亡(https://origin-coronavirus.jhu.edu/map.html)。目前COVID-19大流行浪潮的结束时间和最终严重程度仍不确定。与此同时,流感季节与目前的COVID-19大流行合并,可能会带来更多的挑战,对公共卫生构成更大的威胁。
关于季节性流感是否会影响COVID-19大流行的严重性,以及在即将到来的冬季是否有必要接种流感疫苗,有很多争论。有人推测,甲型流感病毒(IAV)感染可能因SARS-CoV-2继发感染而导致更严重的疾病,或者这两种病毒的共同感染会导致更严重的疾病。然而,目前还没有实验数据显示IAV和SARS-CoV-2之间的关系。
在一项新的研究中,来自中国武汉大学的研究人员提供了第一个实验证据,证明IAV在先感染强烈地促进了SARS-CoV-2病毒在细胞和动物中的进入和感染性。这些数据强调,在SARS-CoV-2大流行季节预防流感是非常重要的。相关研究结果发表在2021年4月的Cell Research期刊上,论文标题为“Coinfection with influenza A virus enhances SARS-CoV-2 infectivity”。

自然界中经常发生病毒的共同感染。一些研究已表明,登革热病毒和寨卡病毒之间通过抗体依赖性增强作用而产生了积极的相互作用。还有研究已表明,普通感冒病毒和SARS-CoV-2之间通过预先存在的免疫力产生了消极的相互作用。在这项新的研究中,通过IAV和SARS-CoV-2假病毒或活病毒的共同感染,这些作者观察到SARS-CoV-2在细胞培养物和小鼠中的感染性大大增强。这种增强与ACE2的表达水平增加有关,其中ACE2是SARS-CoV-2进入宿主细胞的一个主要受体。他们检测到在IAV感染后,A549细胞的ACE2 mRNA水平增加了2至3倍。然而,在IAV和SARS-CoV-2共同感染后,检测到ACE2 mRNA水平有更大的增加(28倍)。
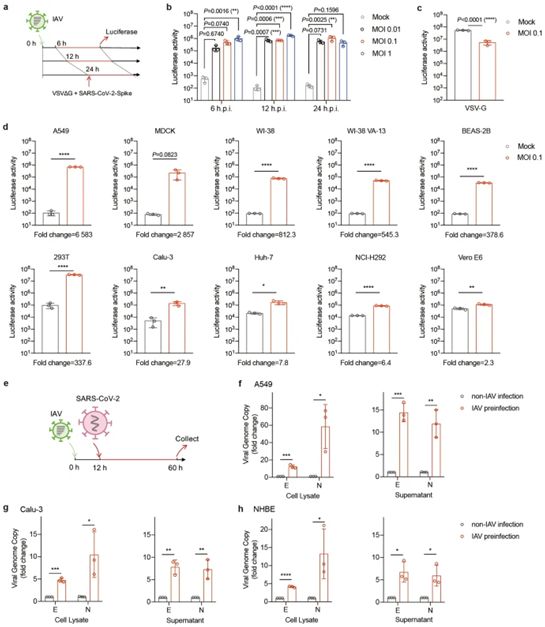
IAV促进SARS-CoV-2病毒的感染性。图片来自Cell Research, 2021, doi:10.1038/s41422-021-00473-1。
这些作者猜测IAV感染诱导了ACE2的温和表达,从而允许SARS-CoV-2病毒进入,随后的SARS-CoV-2增殖以正反馈的模式进一步增强了ACE2的表达。在K18-hACE2小鼠中,这种共感染使得气道上皮细胞中位于人类K18启动子控制下的ACE2表达增加了6.5倍(低于A549细胞中处于天然人ACE2启动子控制下的ACE2表达的28倍增加)。K18-hACE2小鼠中ACE2的诱导倍数较低,可能是由于只在转录后和翻译水平上进行调节,因为IAV和SARS-CoV-2共同感染对hK18启动子没有影响(数据未显示)。尽管如此,他们的数据显示,当敲降ACE2时,IAV介导的SARS-CoV-2感染的增强作用被完全取消,这再次表明ACE2是SARS-CoV-2感染增强的一个主要原因,尽管其他因素也可能起作用。详细机制仍需进一步研究。
有趣的是,在测试的病毒中,只有IAV,而不是人呼吸道合胞病毒(HRSV)、人副流感病毒(HPIV)、人类鼻病毒3(HRV3),能增强SARS-CoV-2的感染。HRSV、HPIV和HRV3三种病毒是引起人类普通感冒的常见病原体,但这些病毒对SARS-CoV-2的感染性没有影响。此外,这些作者通过比较H1N1和H3N2的天然分离株以及B型流感病毒,证实了IAV的普遍影响。此外,目前发生D614G突变的SARS-CoV-2的感染性也可以被IAV在先感染所刺激。IAV增强SARS-CoV-2感染性的独特能力表明,这种流感病毒是当前冠状病毒大流行期间需要预防和控制的关键病原体。
由于这些作者的数据显示IAV仍然可以促进IFNAR-/-A549细胞中的SARS-CoV-2感染,这表明IAV感染诱导的内源性干扰素(IFN)不足以抑制SARS-CoV-2感染。相反,这些作者利用SARS-CoV-2假病毒获得的数据以及其他人利用SARS-CoV-2假病毒或SARS-CoV-2活病毒获得的数据都证明,外源性IFN至少在细胞培养物中可以强烈抑制SARS-CoV-2的感染(很可能是通过包括IFMIT在内的众多ISG基因的抗病毒作用),基于此,应当区分内源性IFN和外源性IFN在共感染模型中的作用。有趣的是,IAV和SARS-CoV-2的共感染大多发生在同一感染的A549细胞中,进一步支持内源性IFN在共感染中发挥的作用有限,因为它必须作用于邻近的非感染细胞。
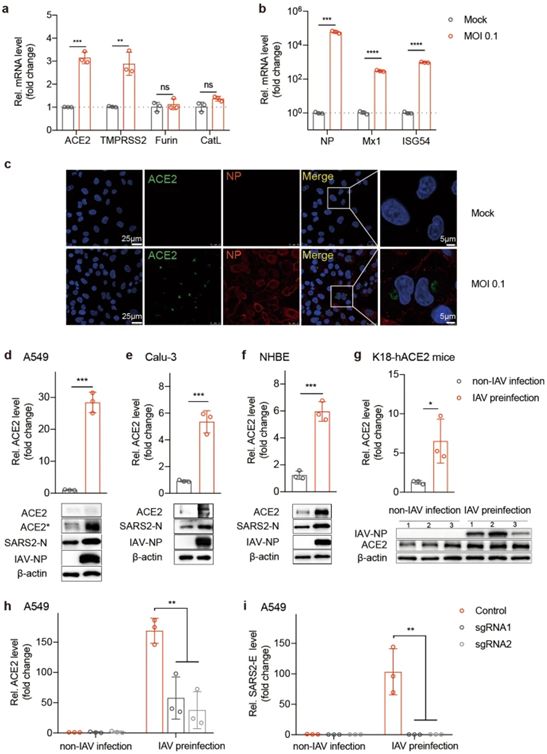
ACE2对IAV促进SARS-CoV-2感染至关重要。图片来自Cell Research, 2021, doi:10.1038/s41422-021-00473-1。
这些作者进一步测试了单独表达IAV基因片段是否能刺激SARS-CoV-2感染。他们的数据显示,编码PB1的IAV基因组片段2对SARS-CoV-2的感染性和ACE2的表达表现出最大的促进作用。PB1介导的SARS-CoV-2感染性增强的详细分子机制还需开展进一步研究。尽管如此,IAV基因组片段2编码另外两种病毒蛋白PB1-F2和PB1-N40,以调节宿主细胞。PB1-F2是一种促凋亡因子,可以调节先天免疫。PB1-N40与许多宿主因子相互作用,有助于病毒的致病性。总之,IAV基因组片段2可能促进SARS-CoV-2感染的事实进一步证实了IAV和SARS-CoV-2之间独特的正向相互作用。
重要的是,IAV和SARS-CoV-2共同感染的增强表型与IFN信号无关,但在同时感染灭活IAV的细胞中并未观察到这一点。因此,应建议具有较高共同感染风险的人群接种流感疫苗(尤其是灭活流感疫苗)以抑制流感病毒感染。这些研究结果还提醒,在即将到来的冬季,鼓励对共同感染进行监测。此外,保持社交距离和戴口罩有利于保护人们免受这两种病毒或其中任何一种病毒的传播。(生物谷 Bioon.com)
参考资料:
Lei Bai et al. Coinfection with influenza A virus enhances SARS-CoV-2 infectivity. Cell Research, 2021, doi:10.1038/s41422-021-00473-1.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


