1型神经纤维瘤病(NF1)药物!阿斯利康新型口服激酶抑制剂Koselugo在欧盟即将获批,美国已上市!
来源:本站原创 2021-04-26 23:02
Koselugo具有显著临床益处:客观缓解率(ORR)为66%,可持续缩小肿瘤体积、缓解疼痛、改善日常功能和生活质量。

2021年04月26日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议有条件批准靶向抗癌药Koselugo(selumetinib),该药是一种新型口服激酶抑制剂,用于1型神经纤维瘤病(NF1)儿科患者治疗症状性、不可切除性丛状神经纤维瘤(PN)。现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者预计在未来2个月做出最终审查决定。如果获得批准,Koselugo将成为欧洲第一个治疗NF1的药物。
NF1是一种使人衰弱的神经系统遗传性疾病,全球发病率为每3000人中就有一例。在30-50%的NF1患者中,肿瘤发生在神经鞘上(丛状神经纤维瘤[PN1]),可引起临床问题,例如:毁容、气道功能障碍、视力障碍、膀胱/肠道功能障碍。
2020年4月,Koselugo获得美国FDA批准,用于年龄≥2岁的NF1儿科患者,治疗NF1相关的症状性、不能手术的丛状神经纤维瘤(PN)。值得一提的是,Koselugo是美国FDA批准的第一种治疗NF1的药物。此前,Koselugo被授予了治疗NF1的孤儿药资格(ODD)和突破性药物资格(BTD)。Koselugo是一种激酶抑制剂,意味着它可通过关键酶发挥作用,从而阻止肿瘤细胞的生长。
CHMP的积极审查意见,基于II期SPRINT Stratum 1试验的结果。这是一项由美国国家癌症研究所(NCI)癌症治疗评估项目(CTEP)赞助的试验,相关结果已发表于国际顶级医学期刊《新英格兰医学杂志》(NEJM),详见:Selumetinib in Children with Inoperable Plexiform。
数据显示,Koselugo(口服,每日2次)单药治疗对患者具有显著的临床益处:可持续缩小肿瘤体积、缓解疼痛、改善日常功能和总体健康相关生活质量。该试验中,Koselugo治疗的客观缓解率(ORR)为66%,50例患者中有33例确认部分应答。ORR定义为肿瘤体积减少至少20%。
丛状神经纤维瘤(PN)(图片来源:storytrender.com)
NF1是一种致衰性、进行性、常常导致毁容的罕见疾病,这种疾病通常始于生命早期,由特定基因的突变或缺陷引起。NF1通常在儿童早期确诊,大约3000个婴儿中就有一个出现NF1,其特征是肤色(色素沉着)变化、神经和骨骼损伤、一生中发生良性和恶性肿瘤的风险。30%-50%的NF1患者出现一处或多处丛状神经纤维瘤(PN)。PN的主要治疗方法是手术切除。不幸的是,由于这些肿瘤的位置或体积,许多患者不适合进行手术。此外,NP通常在最佳手术切除后复发,因此代表了一个医疗需求未满足的重要领域。
SPRINT Stratum 1试验入组了50例儿科患者(中位年龄10.2岁,范围:3.5-17.4),这些儿童患有NF1和不能手术的PN(定义为不能完全切除但不会对患者造成严重发病风险的PN)。最常见的神经纤维瘤相关症状是毁容(44例)、运动功能障碍(33例)和疼痛(26例)。试验中,患者每天2次口服25 mg/m2(已批准的推荐剂量)的Koselugo,直到病情恶化或出现不可接受的不良反应。试验期间对患者肿瘤体积的变化和肿瘤相关疾病症状进行常规评估,并测定了总缓解率(ORR),定义为:3-6个月通过MRI证实有完全缓解或部分缓解(PN肿瘤体积减少≥20%)的患者比例。
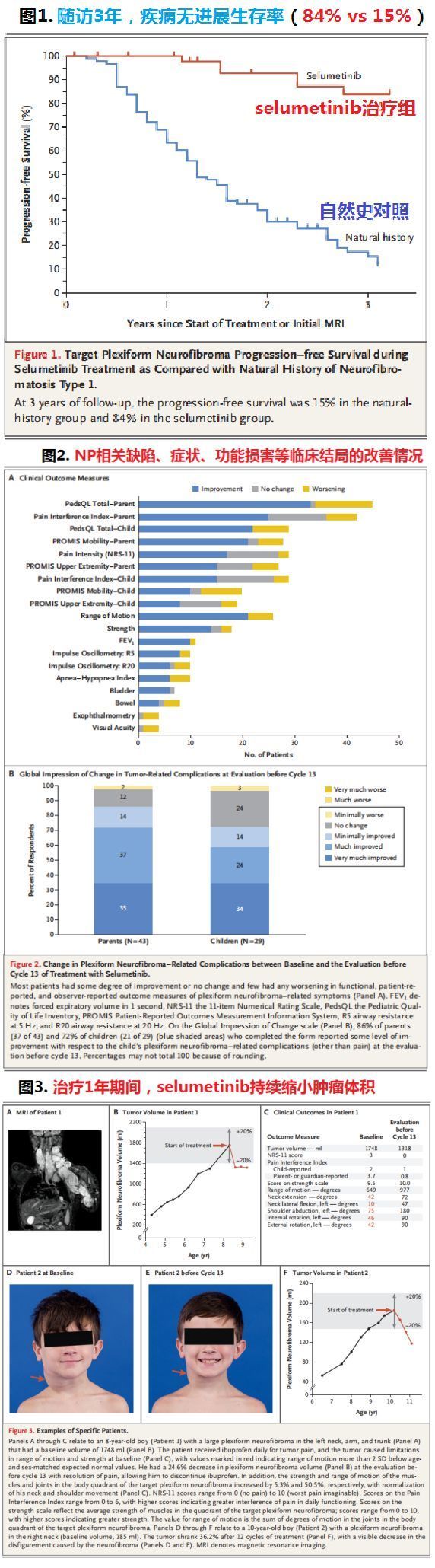
SPRINT Stratum 1临床试验数据(点击图片,查看大图)
NEJM上发表的数据显示:截至2019年3月29日,50例患者中有35例患者确认缓解,即Koselugo每日二次口服单药治疗的总缓解率(ORR)为70%(n=35/50),所有患者均为部分缓解(PR)。在确认缓解的35例患者中,有28例(80%)表现出持续缓解(缓解持续时间≥1年)。
此外,试验中也评估了Koselugo对患者其他临床结果的影响,包括PN相关缺陷、症状和功能损害的变化。尽管评估每个PN相关发病率(如缺陷、疼痛、力量和活动性问题、气道压迫、视力损害和膀胱或肠功能障碍)的患者样本量很小,但治疗期间PN相关缺陷、症状和功能损害也表现出改善。
具体而言:治疗1年后,患者报告的肿瘤疼痛强度评分平均下降2分,被认为具有临床意义的改善。此外,在儿童报告和父母报告的日常功能(分别为38%和50%)和总体健康相关生活质量(分别为48%和58%)以及力量(56%)和动作范围(38%)的功能结局中,也观察到临床意义的改善。
随访3年时,Koselugo治疗组疾病无进展生存率为84%,相比之下,疾病自然史对照组的无进展生存率仅为15%。试验期间,有5例患者因可能与Koselugo相关的毒性作用而停止治疗,6例患者病情恶化。最常见的毒性反应是恶心、呕吐、腹泻、肌酸磷酸激酶水平无症状升高、痤疮样皮疹、甲沟炎。
Koselugo活性药物成分selumetinib分子结构式(图片来源:lclabs.com)
Koselugo的活性药物成分为selumetinib,这是一种口服、强效、选择性MEK1/2激酶抑制剂。NF1基因编码神经纤维瘤蛋白(neurofibromin),该蛋白对RAS/MAPK通路进行负调控,帮助控制细胞生长、分化和存活。NF1基因突变可能导致RAS/RAF/MEK/ERK信号途径失调,而这可能导致细胞以不受控制的方式生长、分裂和复制,并可能导致肿瘤生长。selumetinib通过抑制这条途径中的MEK酶,潜在地抑制肿瘤生长。目前,selumetinib正在临床研究中评估作为单药疗法以及联合其他疗法治疗多种类型肿瘤的潜力。
selumetinib由Array BioPharma发现,阿斯利康于2003年授权获得了该化合物的全球独家权利。2018年7月,阿斯利康与默沙东达成肿瘤学战略合作,在全球范围内共同开发和商业化selumetinib和PARP抑制剂Lynparza。目前,双方正在开展I/II期临床研究SPRINT,在无法手术的NF1相关丛状神经纤维瘤(PN)儿科患者中探索selumetinib的潜在益处。(生物谷Bioon.com)
原文出处:Selumetinib recommended for approval in the EU by CHMP as the first medicine for paediatric patients with neurofibromatosis type 1 and plexiform neurofibromas
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->



