胆管癌靶向新药!大鹏制药共价FGFR抑制剂futibatinib治疗晚期肝内胆管癌:总缓解率41.7%!
来源:本站原创 2021-04-12 17:27
目前,Incyte公司Pemazyre已在美国、欧盟、日本获批上市,是第一个治疗胆管癌的靶向药,信达生物已将该药引进中国开发。

2021年04月12日讯 /生物谷BIOON/ --日本药企大鹏制药(Taiho Pharmaceutical)旗下肿瘤学公司Taiho Oncology近日在美国癌症研究协会(AACR)2021年会上公布了共价结合FGFR抑制剂futibatinib(TAS-120)2期FOENIX-CCA2研究的疗效和安全性数据。这是一项单臂多中心研究,正在评估futibatinib治疗携带FGFR2基因重排(包括基因融合)、接受过至少一种疗法治疗失败的局部晚期或转移性肝内胆管癌(intrahepatic cholangiocarcinoma,iCCA)患者。
该试验中,103例携带FGFR2基因重排(包括基因融合)、先前接受过1种或多种系统疗法、局部晚期或转移性不可切除性iCCA患者,接受每天一次20mg剂量futibatinib治疗,直至疾病进展或不可接受的毒性作用。
结果显示,该研究达到了独立中心审查评估确定的客观缓解率(ORR)>20%的主要终点:futibatinib治疗的ORR为41.7%。次要终点方面,缓解持久,中位缓解持续时间(DOR)为9.7个月,72%的缓解时间≥6个月,疾病控制率(DCR)为82.5%。中位无进展生存期(PFS)为9.0个月、中位总生存期(OS)为21.7个月,72%的患者在12个月时存活。
安全性方面,常见的治疗相关不良事件(TRAE)为高磷血症(85%)、脱发(33%)和口干(30%)。最常见的3级TRAE是高磷血症(30%),经适当的治疗后症状消失。报告了一例4级转氨酶升高,没有治疗相关死亡。
该研究的首席研究员、美国马萨诸塞州总医院癌症中心肿瘤内科医师Lipika Goyal医学博士表示:“FOENIX-CCA2研究的结果对于FGFR2基因融合或其他重排的难治性肝内胆管癌患者具有重要意义,因为futibatinib显示有意义的治疗缓解,ORR为41.7%,缓解持久性良好。这些结果代表了胆管癌精确药物前景的另一个例子,并表明如果获得批准,futibatinib有潜力为难治性CCA患者提供一个新的治疗选择。”
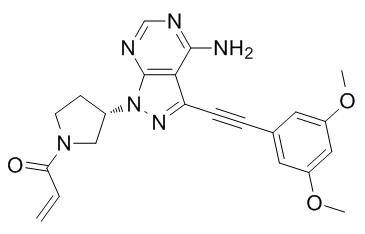
futibatinib(TAS-120)分子结构式(图片来源:macklin.cn)
2021年2月,基于FOENIX-CCA2研究的数据,美国FDA授予了futibatinib突破性药物资格(BTD),用于治疗携带FGFR2基因重排(包括基因融合)、先前接受过治疗的局部晚期或转移性胆管癌(cholangiocarcinoma,CCA)患者。在2018年,FDA还授予了futibatinib治疗CCA的孤儿药资格(ODD)。
futibatinib(TAS-120)是一款在研的、口服、强效、选择性、不可逆的FGFR1、2、3、4小分子抑制剂,目前正被开发作为治疗FGFR1-4基因异常的晚期实体瘤(包括胆管癌)患者的一种潜在疗法。在携带FGFR1-4基因畸变的肿瘤中,futibatinib可选择性地和不可逆地结合到FGFR1-4的ATP结合口袋,导致FGFR介导的信号转导通路的抑制、肿瘤细胞增殖的减少和肿瘤细胞死亡的增加。
Taiho Oncology高级副总裁兼首席医疗官Martin J.Birkhofer医学博士表示:“由于肝内胆管癌(iCCA)患者的生存率普遍很低,因此安全有效的新治疗方案代表着一个重大进步。我们期待着与监管机构分享这些数据,以支持批准这一重要的治疗药物。”
胆管癌-cholangiocarcinoma
胆管癌(cholangiocarcinoma,CCA)是一种发生于胆管的癌症,可根据其解剖学起源进行分类:肝内胆管癌(iCCA)发生于肝内胆管,肝外胆管癌(eCCA)发生于肝外胆管。CCA患者在确诊时通常已处于预后不佳的后期或晚期阶段。CCA的发病率因地区而异,在北美和欧洲的发病率在0.3-3.4/100000。iCCA的5年生存率(所有SEER分期加起来)为9%。
CCA的主要治疗方法是手术切除。如果肿瘤不能通过手术完全切除,并且手术切除的组织边缘显示癌细胞(也称为阳性边缘),则可以使用放疗和化疗。三期和四期癌症都不能通过手术完全切除。目前,标准的治疗方案仅限于放疗、姑息治疗、肝移植、手术、化疗和介入放射学。
成纤维细胞生长因子受体(FGFR)在肿瘤细胞增殖、存活、迁移和血管生成(新生血管的形成)中起着重要作用。FGFR中的融合、重排、易位和基因扩增与多种肿瘤的发生发展密切相关。FGFR2融合或重排几乎只发生在iCCA中,在10-16%的患者中观察到。

Pemazyre-pemigatinib(FGFR抑制剂,图片来源:medchemexpress.cn)
CCA靶向治疗方面,信达生物合作伙伴Incyte公司开发的药物Pemazyre分别于2020年4月、2021年3月获得美国、欧盟和日本批准,用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者。
值得一提的是,Pemazyre是美国、日本、欧盟第一个也是唯一一个针对胆管癌的靶向疗法,该药可通过阻断肿瘤细胞中的FGFR2来阻止肿瘤细胞的生长和扩散。由于胆管癌是一种医疗需求严重未满足的毁灭性癌症,Pemazyre之前已被授予了孤儿药资格、突破性药物资格、优先审查资格、加速评估。
Pemazyre的活性药物成分pemigatinib是一种针对FGFR异构体1、2、3的强效、选择性、口服小分子抑制剂。在临床前研究中,pemigatinib已被证实针对发生FGFR基因改变的癌细胞具有强效和选择性药理学活性。
Pemazyre在美国、日本、欧盟的监管批准,均基于基于FIGHT-202研究的数据。该研究在先前已接受过治疗的局部晚期或转移性胆管癌患者中开展,评估了Pemazyre的疗效和安全性。该研究的结果最近在欧洲肿瘤内科学会(ESMO)2019年大会上公布,数据显示:在携带FGFR2融合或重排的患者(队列A)中,中位随访15个月,Pemazyre单药治疗的总缓解率(ORR)为36%(主要终点),中位缓解持续时间(DoR)为7.49个月(次要终点)。
2018年12月,信达生物与Incyte公司达成战略合作和独家授权许可协议,推进3款药物(itacitinib,parsaclisib,pemigatinib)的单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化。根据合作协议条款,Incyte公司将收到信达生物支付的4000万美元首付款,以及2019年在中国首次递交新药申请后的第二笔2000万美元现金付款。此外,Incyte将有资格获得高达1.29亿美元的潜在开发里程碑付款,以及高达2.025亿美元的潜在商业里程碑付款。(生物谷Bioon.com)
原文出处:Taiho Oncology Announces Presentation of Phase 2 Data for Futibatinib (TAS-120) in Advanced Intrahepatic Cholangiocarcinoma at Virtual AACR Annual Meeting 2021
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


