三阴性乳腺癌(TNBC)重磅新药!吉利德Trodelvy获美国FDA批准:延长生存期的疗法!
来源:本站原创 2021-04-09 00:52
Trodelvy是第一个显著延长TNBC患者无进展生存期(PFS)和总生存期(OS)的药物。

2021年04月08日讯 /生物谷BIOON/ --吉利德科学(Gilead)近日宣布,美国食品和药物管理局(FDA)已授予靶向抗癌药Trodelvy(sacituzumab govitecan-hziy,SG)完全批准,该药用于治疗:先前已接受过至少2种疗法、其中至少1种疗法治疗转移性疾病的不可切除性局部晚期或转移性三阴性乳腺癌(TNBC)成人患者。该批准将先前的加速批准转为了完全批准,同时扩大了先前的Trodelvy适应症,纳入了已接受过至少2种疗法、其中至少1种治疗转移性疾病的不可切除性局部晚期或转移性TNBC成人患者。而之前的适应症是:已接受过至少2种疗法治疗转移性疾病的转移性TNBC成人患者。
特别值得一提的是,Trodelvy是第一个可提高mTNBC患者无进展生存期(PFS)和总生存期(OS)的疗法,标志着TNBC治疗方面的一个重大进步。在3期ASCENT研究中,与化疗相比,Trodelvy将PFS显著延长(中位PFS:4.8个月 vs 1.7个月、疾病进展或死亡风险显著降低57%(HR=0.43,p<0.0001)、将OS显著延长(中位OS:11.8个月 vs 6.9个月)、死亡风险显著降低49%(HR=0.51,p<0.0001)。
ASCENT研究的全球首席研究员、哈佛医学院医学教授Aditya Bardia表示:“从历史上看,TNBC女性患者几乎没有有效的治疗选择,而且预后很差。今天FDA的批准,反映了里程碑式的ASCENT研究中统计学上显著的生存益处,并将Trodelvy定位为治疗TNBC的潜在新护理标准。”
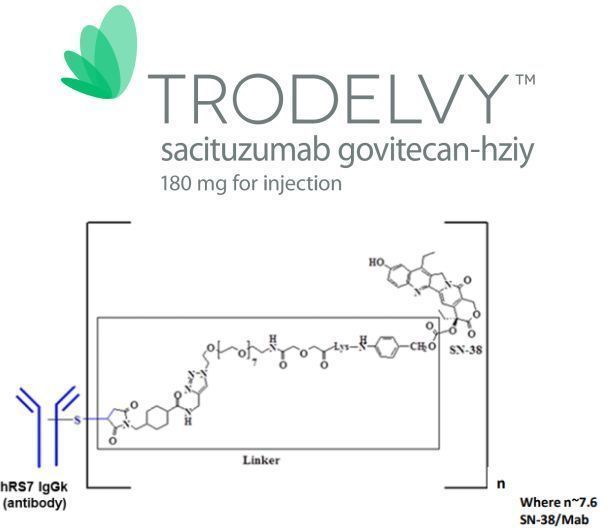
Trodelvy是一款靶向Trop-2的新型、首创的抗体偶联药物(ADC),由靶向TROP-2抗原的人源化IgG1抗体与化疗药物伊立替康(一种拓扑异构酶I抑制剂)的代谢活性产物SN-38偶联而成,药物-抗体比高达7.6:1。Trop-2是一种在许多上皮性肿瘤(包括TNBC)中频繁表达的细胞表面蛋白,在90%以上的TNBC中表达。Trodelvy与Trop-2靶向结合并递送抗癌制剂SN-38来杀死癌细胞。
Trodelvy由Immunomedics公司开发,其专有ADC平台的核心是使用一种新型的链接子,这种链接子不需要酶来释放有效荷载,可在肿瘤细胞内和肿瘤微环境中递送活性药物,从而产生近旁效应(bystander effect)。2019年4月,云顶新耀(Everest Medicines)与Immunomedics签订协议,获得了Trodelvy在大中华区、韩国、蒙古国、东南亚国家和地区的权益。2020年9月,吉利德以210亿美元收购Immunomedics,将Trodelvy收入囊中。
目前,Trodelvy已在美国上市。在欧盟方面,Trodelvy最近已进入加速评估。此外,Trodelvy治疗mTNBC在英国、加拿大、瑞士、澳大利亚的监管审查正在进行中。通过合作伙伴云顶新耀,Trodelvy治疗mTNBC也正在接受新加坡的监管审查。此外,Trodelvy的一份新适应症申请也正在接受美国FDA的审查:用于治疗先前在新辅助/辅助、转移性疾病中已接受过含铂化疗和PD-1抑制剂或PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌(UC)成人患者。
2020年4月,Trodelvy获得美国FDA加速批准,用于先前已接受过至少2种疗法治疗转移性疾病的mTNBC成人患者。值得一提的是,Trodelvy是FDA批准的第一个专门治疗复发或难治性mTNBC的ADC药物,也是FDA批准的第一个以Trop-2为靶点的ADC药物。该加速批准基于单臂多中心II期研究的总缓解率(ORR=33.3%)和缓解持续时间(中位DOR=7.7个月)数据。
此次完全批准,基于3期ASCENT(NCT02574455)试验的结果。这是一项国际性、开放标签III期研究,共入组了500多例mTNBC患者,这些患者先前接受过至少2种疗法治疗转移性疾病。研究中,患者被随机分为2组,一组接受Trodelvy,另一组接受医生选择的化疗。主要终点是无进展生存期(PFS),次要终点包括总生存期(OS)、ORR、DOR、发生缓解的时间、安全性和耐受性。该研究是在FDA特别方案评估(SPA)下设计的,目的是验证Trodelvy在支持其批准的II期研究中所显示出的有希望的疗效和安全性。
结果显示,该研究达到了主要终点和关键次要终点:Trodelvy组与化疗组相比在PFS方面有统计学意义的显著改善(中位PFS:4.7个月 vs 1.7个月)、疾病进展风险显著降低57%(HR=0.43,95%CI:0.35-0.54,p<0.0001)。此外研究也达到了关键次要终点:Trodelvy组与化疗组相比在OS方面有统计学意义的显著改善(中位OS:11.8个月 vs 6.9个月)、死亡风险显著降低49%(HR=0.51;95%CI:0.41-0.62;p<0.0001)。此外,Trodelvy组与化疗组相比ORR也显著提高(35% vs 5%)。
乳腺癌是女性中最常见的癌症类型,全球每年确诊超过200万例。三阴乳腺癌(TNBC)约占所有乳腺癌比例的15%,与其他类型乳腺癌相比,TNBC在50岁以下女性中更为常见。TNBC特指雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2(HER-2)三者均为阴性表达的乳腺癌,进展迅速,预后极差,5年生存率不到15%。TNBC对激素疗法和HER2靶向疗法(如罗氏赫赛汀Herceptin)均无效,临床治疗选择非常有限,主要依靠化疗。
TNBC治疗方面,2019年3月,罗氏PD-L1肿瘤免疫疗法Tecentriq(泰圣奇,通用名:atezolizumab,阿替利珠单抗)获美国FDA批准,联合化疗(Abraxane)一线治疗PD-L1阳性局部晚期或转移性三阴性乳腺癌(TNBC)患者。此次批准,使Tecentriq+Abraxane组合成为治疗TNBC的首个癌症免疫治疗方案。
2020年11月,默沙东Keytruda(可瑞达,通用名:pembrolizumab,帕博利珠单抗)获得美国FDA批准,联合化疗治疗肿瘤表达PD-L1(合并阳性评分[CPS]≥10)的局部复发性不可切除性或转移性三阴性乳腺癌(TNBC)患者。值得一提的是,这也是Keytruda在乳腺癌领域的首次批准。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->