胆管癌靶向新药!美国FDA授予大鹏制药共价FGFR抑制剂futibatinib(TAS-120)突破性药物资格!
来源:本站原创 2021-04-05 17:17
目前,Incyte公司Pemazyre已在美国、欧盟、日本获批上市,是第一个治疗胆管癌的靶向药,信达生物已将该药引进中国开发。

2021年04月05日讯 /生物谷BIOON/ --日本药企大鹏制药(Taiho Pharmaceutical)及旗下肿瘤学公司Taiho Oncology近日联合宣布,美国食品和药物管理局(FDA)已授予共价结合FGFR抑制剂futibatinib(TAS-120)突破性药物资格(BTD),用于治疗携带FGFR2基因重排(包括基因融合)、先前接受过治疗的局部晚期或转移性胆管癌(cholangiocarcinoma,CCA)患者。在2018年,FDA还授予了futibatinib治疗CCA的孤儿药资格(ODD)。
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病、并且有初步临床证据表明该药与现有治疗药物相比在一个或多个具有临床意义的终点方面有显著改善的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。
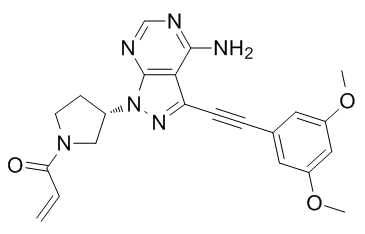
futibatinib(TAS-120)分子结构式(图片来源:macklin.cn)
futibatinib(TAS-120)是一款在研的、口服、强效、选择性、不可逆的FGFR1、2、3、4小分子抑制剂,目前正被开发作为治疗FGFR1-4基因异常的晚期实体瘤(包括胆管癌)患者的一种潜在疗法。在携带FGFR1-4基因畸变的肿瘤中,futibatinib可选择性地和不可逆地结合到FGFR1-4的ATP结合口袋,导致FGFR介导的信号转导通路的抑制、肿瘤细胞增殖的减少和肿瘤细胞死亡的增加。
FDA授予futibatinib BTD,是基于2期FOENIX-CCA2研究的疗效和安全性结果。该研究的详细结果将在2021年4月9日至14日举行的2021年美国癌症研究协会(AACR)年会上发表。
此前于2020年9月在ESMO大会上公布的中期数据显示:随访≥6个月,futibatinib治疗的客观缓解率(ORR)为37.3%、中位缓解持续时间(DOR)为8.3个月、疾病控制率(DCR)为82%。特别是,在所有基线特征亚组(包括年龄、性别、先前接受的系统性疗法)中,均观察到治疗缓解,包括年龄≥65岁的老年人群(ORR=57%;n=8/14)。研究中,futibatinib的不良事件可控。
Taiho Oncology高级副总裁兼首席医疗官Martin J.Birkhofer医学博士表示:“局部晚期和转移性胆管癌患者,目前的预后很差,尤其是一线化疗失败后没有标准的治疗方法。我们很高兴FDA已经认可了futibatinib在以前治疗过的CCA患者中的潜在益处。我们期待着与FDA和其他监管当局继续对话,为全球胆管癌患者提供futibatinib。”
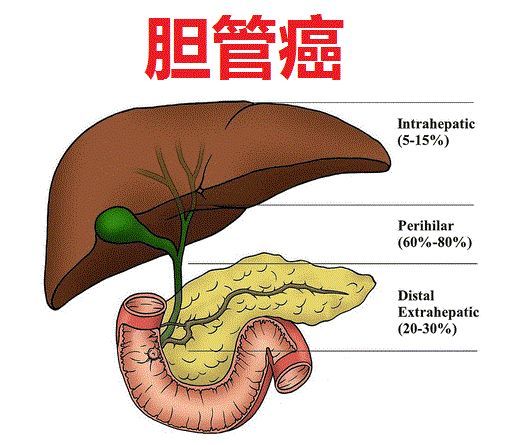
胆管癌-cholangiocarcinoma
胆管癌(cholangiocarcinoma,CCA)是一种发生于胆管的癌症,可根据其解剖学起源进行分类:肝内胆管癌(iCCA)发生于肝内胆管,肝外胆管癌(eCCA)发生于肝外胆管。CCA患者在确诊时通常已处于预后不佳的后期或晚期阶段。CCA的发病率因地区而异,在北美和欧洲的发病率在0.3-3.4/100000。iCCA的5年生存率(所有SEER分期加起来)为9%。
CCA的主要治疗方法是手术切除。如果肿瘤不能通过手术完全切除,并且手术切除的组织边缘显示癌细胞(也称为阳性边缘),则可以使用放疗和化疗。三期和四期癌症都不能通过手术完全切除。目前,标准的治疗方案仅限于放疗、姑息治疗、肝移植、手术、化疗和介入放射学。
成纤维细胞生长因子受体(FGFR)在肿瘤细胞增殖、存活、迁移和血管生成(新生血管的形成)中起着重要作用。FGFR中的融合、重排、易位和基因扩增与多种肿瘤的发生发展密切相关。FGFR2融合或重排几乎只发生在iCCA中,在10-16%的患者中观察到。
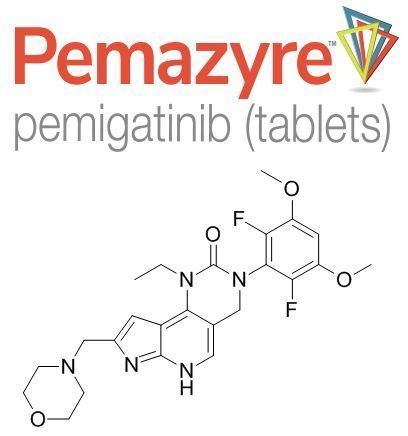
Pemazyre-pemigatinib(FGFR抑制剂,图片来源:medchemexpress.cn)
CCA靶向治疗方面,信达生物合作伙伴Incyte公司开发的药物Pemazyre分别于2020年4月、2021年3月获得美国、欧盟和日本批准,用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者。
值得一提的是,Pemazyre是美国、日本、欧盟第一个也是唯一一个针对胆管癌的靶向疗法,该药可通过阻断肿瘤细胞中的FGFR2来阻止肿瘤细胞的生长和扩散。由于胆管癌是一种医疗需求严重未满足的毁灭性癌症,Pemazyre之前已被授予了孤儿药资格、突破性药物资格、优先审查资格、加速评估。
Pemazyre的活性药物成分pemigatinib是一种针对FGFR异构体1、2、3的强效、选择性、口服小分子抑制剂。在临床前研究中,pemigatinib已被证实针对发生FGFR基因改变的癌细胞具有强效和选择性药理学活性。
Pemazyre在美国、日本、欧盟的监管批准,均基于基于FIGHT-202研究的数据。该研究在先前已接受过治疗的局部晚期或转移性胆管癌患者中开展,评估了Pemazyre的疗效和安全性。该研究的结果最近在欧洲肿瘤内科学会(ESMO)2019年大会上公布,数据显示:在携带FGFR2融合或重排的患者(队列A)中,中位随访15个月,Pemazyre单药治疗的总缓解率(ORR)为36%(主要终点),中位缓解持续时间(DoR)为7.49个月(次要终点)。
2018年12月,信达生物与Incyte公司达成战略合作和独家授权许可协议,推进3款药物(itacitinib,parsaclisib,pemigatinib)的单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化。根据合作协议条款,Incyte公司将收到信达生物支付的4000万美元首付款,以及2019年在中国首次递交新药申请后的第二笔2000万美元现金付款。此外,Incyte将有资格获得高达1.29亿美元的潜在开发里程碑付款,以及高达2.025亿美元的潜在商业里程碑付款。(生物谷Bioon.com)
原文出处:FDA Grants Breakthrough Therapy Designation for Taiho Oncology’s Futibatinib for Treatment of Advanced Cholangiocarcinoma
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


