全球BCMA CAR-T疗法!百时美施贵宝Abecma(ide-cel)获美国FDA批准:治疗多发性骨髓瘤!
来源:本站原创 2021-03-28 03:16
Abecma是全球第一个获得监管批准的BCMA导向CAR-T细胞疗法。葛兰素史克Blenrep于2020年8月获批,是全球第一个BCMA靶向疗法。

2021年03月27日/生物谷BIOON/--百时美施贵宝(BMS)与合作伙伴蓝鸟生物(Bluebrid Bio)近日联合宣布,美国食品和药物管理局(FDA)已批准Abecma(idecabtagene vicleucel,ide-cel),该药是一种B细胞成熟抗原(anti-BCMA)导向的嵌合抗原受体(CAR)T细胞疗法,用于治疗复发性/难治性多发性骨髓瘤(R/R MM)成人患者,具体为:既往接受过4种或更多种疗法(包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)的R/R MM成人患者。Abecma的批准上市,将为这类患者提供一种新的、有效的、个性化治疗方案,仅需一次输液即可实现快速、深度、持久的缓解。
Abecma是一种首创(first-in-class)、BCMA导向、个体化免疫细胞疗法,作为一次性输注疗法,治疗接受过3类药物的多发性骨髓瘤患者。该药推荐剂量为300-460 x 10E6的CAR阳性T细胞。BCMA是一种几乎普遍在多发性骨髓瘤癌细胞上表达的蛋白质。作为一种抗BCMA CAR-T细胞疗法,Abecma识别并结合BCMA,导致表达BCMA的细胞死亡。
特别值得一提的是,Abecma是全球第一个获得监管批准的BCMA导向CAR-T细胞疗法,也是美国FDA批准的第5款CAR-T细胞疗法。今年2月初,百时美施贵宝CD19 CAR-T细胞疗法Breyanzi(lisocabtagene maraleucel,liso-cel)获得FDA批准,治疗复发或难治性大B细胞淋巴瘤(R/R LBCL)成人患者。
此次Abecma批准,使得百时美施贵宝成为了第一家同时拥有2款针对CD19和BCMA的CAR-T细胞疗法的制药公司。Abecma通过优先审查程序获得批准,目前也正在接受欧洲药品管理局(EMA)的加速评估。在美国和欧盟,Abecma分别被授予了突破性药物资格(BTD)和优先药物资格(PRIME)。
尽管多发性骨髓瘤(MM)的治疗已取得了进展,但该病仍然是一种不可治愈的疾病,其病程仍以缓解-复发周期循环为主要特征。大多数患者在接受初始治疗后会出现复发,并且随着每次连续治疗,缓解的深度和持续时间以及生存结果都会降低。接受过全部3种主要药物类别(三类暴露:包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)治疗的复发性或难治性多发性骨髓瘤患者,往往表现出不良的临床结果,缓解率很低(20%-30%)、缓解持续时间短(2-4个月)、生存率低。
在三类暴露和难治性多发性骨髓瘤患者中开展的关键性Karmma试验中,接受Abecma单次输注治疗后,大多数(72%)患者获得了快速、深度、持久的缓解。该研究中,Abecma具有良好、可预测的安全性,包括细胞因子释放综合征(CRS)和神经系统毒性(NT),大多是低级别的,且发生早、消退快。
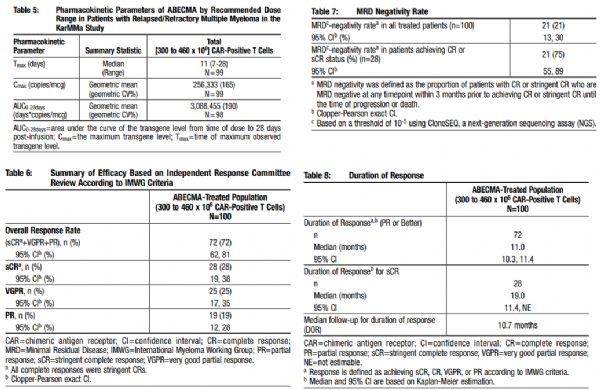
FDA批准Abecma是基于关键II期KarMMa研究的结果。该试验在127例复发或难治性多发性骨髓瘤患者中开展,这些患者至少接受过3类疗法(包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)且对最后一种疗法无效。疗效评估人群包括100例接受了Abecma剂量范围为300-460 x 10E6的CAR阳性T细胞治疗的患者。这些患者中,88%接受过4种或更多种治疗方案、85%为3类难治性。
结果显示:在疗效评估人群(n=100)中,Abecma单次输液治疗的总缓解率(ORR)为72%(95%CI:62-81),28%的患者达到了严格的完全缓解(sCR;95%CI:19-38)。缓解迅速且持久,从接受输液治疗至病情发生缓解的中位时间为30天(范围:15-88天),全部缓解患者中的中位缓解持续时间为11个月(95%CI:10.3-11.4),达到sCR的患者中位缓解持续时间为19个月(95%CI:11.4-NE)。在28例达到sCR的患者中,估计有65%(95%CI:42%-81%)的患者病情缓解至少持续12个月。
该研究中,Abecma在接受治疗的患者中安全性已得到很好的证实,细胞因子释放综合征(CRS)和神经毒性(NT)大多数为低级,具有可预测的早期发病,并能快速消退。
KarMMa研究数据(点击图片:查看大图)
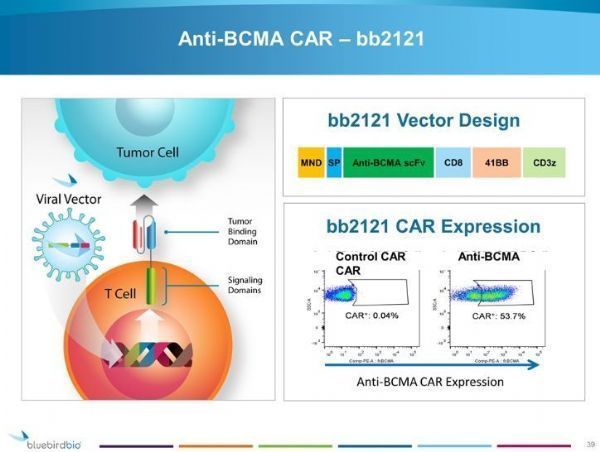
Abecma是全球第一个获得监管批准的BCMA CAR-T细胞疗法,其原理是在患者的T细胞上嵌合BCMA的受体,其制备过程为:从每例患者的血液中分离获得T细胞,使用编码BCMA抗原受体的慢病毒载体对T细胞进行修饰,使T细胞表面表达BCMA受体。治疗时,MM患者先接受2种化疗药物(环磷酰胺和氟达拉滨)预处理,以杀死患者体内现有的T细胞,随后输注bb2121,一旦输注回患者体内,ide-cel就开始寻找并杀死表达BCMA的细胞。
Abecma是百时美施贵宝和蓝鸟生物共同开发、共同推广和利润分享协议的一部分。双方的Abecma综合临床开发项目包括用于早期治疗MM的多项临床研究(KarMMa-2、KarMMa-3、KarMMa-4),包括治疗新诊MM患者。
除了Abecma之外,BMS和蓝鸟生物也正在开发第二代anti-BCMA CAR-T疗法bb2127,这是在第一代CAR-T疗法Abecma基础上进一步开发的产品,结合了一种PI3K抑制信号,可生产出一种富集“记忆T细胞”的CAR-T产品,这是一种寿命更长、更强效的T细胞亚群,具有改善的抗肿瘤活性。
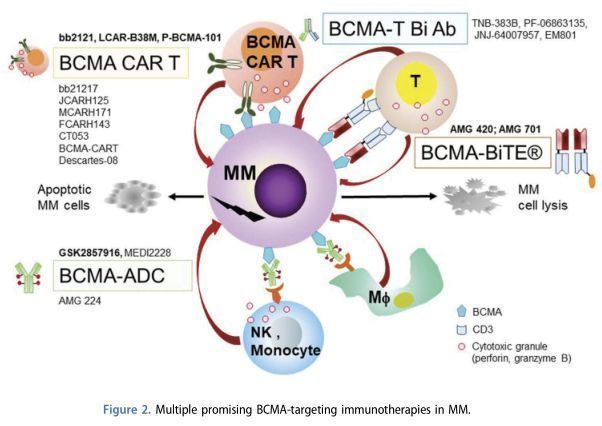
BCMA为靶点的在研MM免疫疗法(来源文献—PMID:31277554)
多发性骨髓瘤(MM)是仅次于非霍奇金淋巴瘤的第二大常见血液学恶性肿瘤。近年来,尽管在化疗、蛋白酶体抑制剂、免疫调节剂沙利度胺衍生物和CD38靶向抗体方面取得了很大的进展,但几乎所有患者最终仍会复发。因此,对新治疗方案存在着迫切需求。MM市场预计2027年将达到290亿美元。
B细胞成熟抗原(BCMA)是一种极其重要的B细胞生物标志物,广泛存在于MM细胞表面,近年来已成为MM和其他血液系统恶性肿瘤的一个非常热门的免疫治疗靶点。目前,针对BCMA开发的免疫疗法超过20种,主要分为3类:嵌合抗原受体T细胞疗法(CAR-T,BMS/蓝鸟生物、诺华为代表)、双特异性抗体(BsAb,安进为代表)、抗体药物偶联物(ADC,葛兰素史克为代表)。
2020年8月,葛兰素史克(GSK)BCMA靶向抗体药物偶联物(ADC)Blenrep(belantamab mafodotin,GSK2857916)获得美国和欧盟批准,用于治疗既往已接受过多种疗法(包括一种免疫调节剂、一种蛋白酶体抑制剂、一种抗CD38抗体)的复发或难治性多发性骨髓瘤(R/R MM)患者。
值得一提的是,Blenrep是全球获批的第一个BCMA靶向疗法。来自关键II期DREAMM-2研究的数据显示,在既往过度预治疗(接受过的治疗方案中位数:7种)的R/R MM患者中,Blenrep 2.5mg/kg剂量组的总缓解率(ORR)为31%(n=30/97),3.4mg/kg剂量组的ORR为34%(n=34/99),数据具有临床意义。来自DREAMM-1研究的数据显示,在BCMA阳性R/R MM患者中,Blenrep治疗的ORR达到了60%。(生物谷Bioon.com)
原文出处:U.S. Food and Drug Administration approves Bristol Myers Squibb’s and bluebird bio’s Abecma (idecabtagene vicleucel), the First Anti-BCMA CAR T Cell Therapy for Relapsed or Refractory Multiple Myeloma
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->