非血红素亚铁双加氧酶(NicX)的催化反应机理研究方面取得重要进展
来源:上海交大 2021-03-03 14:50
近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室微生物分解代谢团队的唐鸿志教授与赵一雷教授等合作在国际权威期刊《Nature Communications》在线发表了题为“Structure-guided insights into heterocyclic ring-cleavage catalysis of the non-heme Fe (
近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室微生物分解代谢团队的唐鸿志教授与赵一雷教授等合作在国际权威期刊《Nature Communications》在线发表了题为“Structure-guided insights into heterocyclic ring-cleavage catalysis of the non-heme Fe (II) dioxygenase NicX”的研究论文,揭示了非血红素亚铁双加氧酶(NicX)的催化反应机理。
2,5-羟基吡啶(DHP)是许多吡啶衍生物分解代谢中的代谢中间体,可导致DNA链断裂,是一种潜在的致癌物,其可以被双加氧酶(NicX)催化开环转化为N-甲酰基马来酸(NFM)。催化苯环开环反应的酶在结构还是机理上都已经被深入的研究,然而催化吡啶环开环反应的酶及催化反应机制的研究却报道较少。
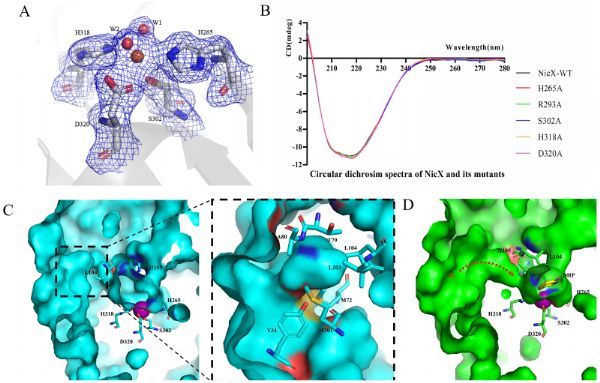
本研究解析了NicX单体及NicX与小分子底物DHP及产物NFM的复合物结构。晶体结构显示NicX是以His265, Ser302, His318 和 Asp320配位金属亚铁离子,以Ser作为亚铁离子配体的非血素亚铁双加氧酶结构蛋白还属于首次报道,如果将这四个残基突变则会使酶失去结合金属亚铁离子的能力。将静息状态的酶同酶结合底物、酶结合产物的结构比较发现,氨基酸残基Leu104-His105在催化反应进程中,起到结合且稳定底物的作用,通过构象的变化会关闭通道II,同时开启一条通往活性中心的疏水性通道。进一步结合QM/MM计算分析,提出了氧气结合顶端位置的催化机制:氧气结合在底物和亚铁离子之间,通过底物吡啶环上的N-H参与质子转移激活氧气分子,促使氧气进攻底物,随后O-O键的断裂而使其中一个氧原子插入吡啶环形成七元环中间体,后续七元环开环生成产物。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->