肺癌超重磅!辅助(术后)疗法:阿斯利康EGFR靶向药Tagrisso(泰瑞沙)获美国FDA批准!
来源:本站原创 2020-12-22 01:30
Tagrisso将改变早期EGFRm肺癌临床实践,3期临床将疾病复发/死亡风险降低80%。

2020年12月21日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)近日宣布,美国食品和药物管理局(FDA)已批准靶向抗癌药Tagrisso(中文商品名:泰瑞沙,通用名:osimertinib,奥希替尼),作为一种辅助(术后)疗法,用于治疗已接受治愈目的的完全肿瘤切除术的早期(IB/II/IIIA期)表皮生长因子受体突变(EGFRm)非小细胞肺癌(NSCLC)成人患者。
Tagrisso适用于肿瘤中携带第19号外显子缺失或携带第21号外显子L858R突变的EGFRm患者。此次批准是通过FDA实时肿瘤学审查(RTOR)试点项目获得批准,另外5个国家通过FDA的Orbis项目参与了同时提交和审查过程。今年7月,FDA授予了Tagrisso治疗上述适应症的突破性药物资格(BTD)。在中国,Tagrisso辅助治疗早期EGFRm NSCLC的申请正在接受优先审查。此外,欧盟也在对这一适应症进行监管审查。
Tagrisso是一种口服的小分子第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),已被全球多个国家(包括美国、日本、中国、欧盟)批准:(1)一线治疗局部晚期或转移性EGFRm NSCLC患者;(2)二线治疗EGFR T790M突变阳性的局部晚期或转移性NSCLC患者。
肺癌是一种毁灭性的疾病,虽然高达30%的NSCLC患者可能诊断的足够早、可接受潜在愈性手术切除,但疾病复发在早期疾病中很常见,近一半在IB期确诊的患者、超过四分之三在IIIA期确诊的患者会在5年内复发。
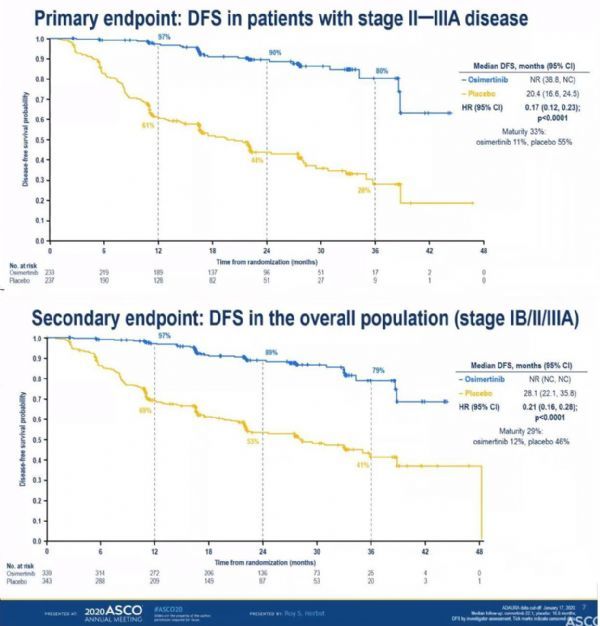
此次批准,基于III期ADAURA研究史无前例的疗效结果,数据显示:在已接受完全肿瘤切除术的早期(IB/II/IIIA期)EGFRm-NSCLC患者中,与安慰剂相比,Tagrisso用于术后辅助治疗显著延长了无病生存期(DFS)、将疾病复发或死亡风险显著降低80%。
值得一提的是,ADAURA试验是评估一种EGFR抑制剂在辅助治疗肺癌方面显示出统计学显著和临床意义益处的第一项全球性临床试验。结果首次证实:一种EGFR抑制剂有潜力改变早期EGFR突变肺癌的进程,并为患者提供治愈希望。
阿斯利康肿瘤事业部执行副总裁Dave Fredrickson表示:“在美国,早期EGFRm NSCLC患者第一次获得了一款靶向性、生物标志物驱动的治疗方法。这一批准打消了手术和化疗后治疗结束的观念,因为ADAURA研究结果表明,Tagrisso治疗可以显著改变这种疾病的病程。我们仍然致力于尽早治疗癌症患者,因为他们可能还有治愈的机会。”
ADAURA是一项随机、双盲、全球性、安慰剂对照III期研究,在682例早期(IB/II/IIIA期)EGFRm-NSCLC患者中开展,这些患者已接受了肿瘤完全切除和可选的标准术后辅助化疗,评估了Tagrisso用于辅助治疗的疗效和安全性。研究中,实验组患者接受Tagrisso 80mg每日一次口服片剂,治疗三年或直至疾病复发。该研究在欧洲、南美、亚洲、中东等20多个国家的200多个临床中心开展。主要终点是II/IIIA期患者中的无病生存期(DFS)、关键次要终点是IB/II/IIIA期患者中的DFS。数据读出最初预计在2022年。
2020年4月,独立数据监测委员会(IDMC)经评估后确定,该研究已取得了压倒性的疗效。根据该结果,IDMC建议对这项研究提前2年揭盲。在数据截止时,总生存期(OS)数据有利于Tagrisso,但尚未成熟。该研究将继续评估OS,这也是研究的另一个次要终点。
2020年ASCO年会上公布的详细数据显示,在II/IIIA期患者中的DFS主要终点方面,Tagrisso用于辅助治疗(术后)将疾病复发或死亡风险降低83%(HR=0.17;95%CI:0.12,0.23;p<0.0001)。关键次要终点——整个研究群体(IB/II/IIIA期患者)的DFS结果显示,Tagrisso将疾病复发或死亡风险降低80%(HR=0.20;95%CI:0.15,0.27;p<0.0001)。2年后,Tagrisso治疗组有89%的患者在术后仍存活无病,安慰剂组为53%。在所有亚组中均观察到一致的DFS结果,包括术后化疗的患者、仅接受手术的患者、亚洲患者、非亚洲患者。该研究中,Tagrisso的安全性和耐受性与先前试验中一致。
ADAURA研究的首席调查员、耶鲁癌症中心和Smilow癌症医院肿瘤科主任Roy S.Herbst医学博士评价称:“此次批准,对于早期EGFRm NSCLC患者来说是一种变革性的重大进步,即使在成功的手术和随后的辅助化疗治疗后,这些患者也面临着很高的复发率。Tagrisso将提供一个急需的新治疗方案,有潜力改变医学实践,改善这些患者的预后。”
肺癌是男性和女性癌症死亡的主要原因,约占所有癌症死亡的五分之一,超过了乳腺癌、前列腺癌和结直肠癌的总和。肺癌广泛地分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中NSCLC占80-85%。大约25-30%的NSCLC患者在确诊时有可切除疾病,大部分可切除的NSCLC患者在手术(完全切除)后最终会复发。
在美国和欧洲约10-15%、亚洲约30-40%的NSCLC患者为EGFR突变(EGFRm)NSCLC,这些患者对表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗特别敏感,这类药物可阻断驱动肿瘤生长的细胞信号通路。
Tagrisso是第三代不可逆EGFR-TKI,能够克服对该类药物中第一、二代EGFR-TKI的耐药性,包括罗氏/安斯泰来特罗凯(Tarveca)、阿斯利康易瑞沙(Iressa)、勃林格殷格翰Gilotrif(afatinib,阿法替尼)。
Tagrisso可抑制EGFR敏感性和EGFR-T790M耐药突变,具有抗中枢神经系统转移的临床活性。截至目前,Tagrisso 40mg和80mg每日一次口服片目前已多个国家(包括美国、日本、中国、欧盟)获得批准用于一线治疗EGFRm晚期NSCLC,并在多个国家(包括美国、日本、中国、欧盟)获得批准用于二线治疗EGFR T790M突变阳性晚期NSCLC患者。
目前,阿斯利康正在开发Tagrisso用于局部晚期不可切除性疾病(LAURA研究)、联合化疗治疗转移性疾病(FLAURA2)、联合潜在的新药解决对EGFR TKI的耐药性(SAVANNAH研究、ORCHARD研究)。(生物谷Bioon.com)
原文出处:Tagrisso approved in the US for the adjuvant treatment of patients with early-stage EGFR-mutated lung cancer
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->