降糖药治疗阿尔茨海默氏症(AD)!诺和诺德启动高剂量口服semaglutide(司美格鲁肽)3期临床项目!
来源:本站原创 2020-12-18 21:32
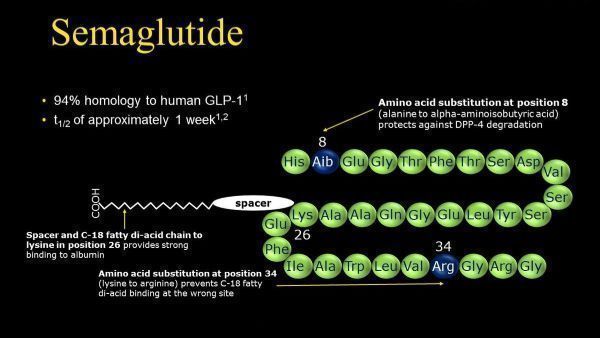
semaglutide是一种长效GLP-1类似物,具有降糖、减肥、降低心血管风险三大功效。

2020年12月18日讯 /生物谷BIOON/ --诺和诺德(Novo Nordisk)近日宣布,决定进入3期临床开发,评估14mg口服semaglutide(中国通用名:司美格鲁肽)用于治疗阿尔茨海默氏症(AD)。14mg口服semaglutide是长效GLP-1类似物semaglutide的一种每日一次口服制剂。该决定是对临床前模型的GLP-1数据进行评估、真实世界的证据研究、大型心血管结果试验的事后分析以及与监管机构的讨论之后做出的。
诺和诺德计划启动一个关键3a期临床项目,入组约3700例早期AD患者。该项目计划于2021年上半年启动,评估每日一次口服semaglutide相对于安慰剂的有效性和安全性。该项目试验中,预期的主治疗期为2年左右。

阿尔茨海默氏症-AD(图片来源于:tecake.in)
诺和诺德执行副总裁兼首席科学官Mads Krogsgaard Thomsen表示:“我们渴望解决严重慢性疾病中高度未满足的医疗需求,因此,我们很高兴在阿尔茨海默氏症中启动semaglutide的3期临床开发。在过去的几十年里,阿尔茨海默氏症一直是一个广泛研究的领域,不幸的是,没有任何重大的医学突破。由于日益增长的未满足医疗需求以及越来越多的证据表明GLP-1具有潜在的治疗作用,我们将研究口服semaglutide治疗早期阿尔茨海默氏症的益处。”
阿尔茨海默氏症(AD)是一个迅速增长的公共卫生问题,对受影响的人及其家庭造成了重大的有害后果,并已导致全球社会经济的重大和日益严重的影响。全世界估计有7000-1亿人患有早期阿尔茨海默氏症(轻度认知障碍和轻度痴呆阶段)。
关于临床前模型、真实世界证据研究和事后分析的数据:
动物研究强调了与AD相关的GLP-1的关键作用,包括改善记忆功能和减少磷酸τ积累。semaglutide已被明确证明可以减少神经炎症,而神经炎症可能会影响认知和功能。
此外,来自丹麦2个全国性注册中心美国Truven索赔数据库和美国FDA FAERS数据库的真实证据支持GLP-1治疗后痴呆症风险降低之间的潜在联系。
最后,在对诺和诺德开展的3项大型心血管结局试验(LEADER,SUSTAIN 6和PIONEER 6)数据的事后分析中,共有47人被确定患有痴呆症,其中32人服用安慰剂,15人服用GLP-1(liraglutide[利拉鲁肽]或semaglutide)。数据有利于GLP-1,显示痴呆的发生率在统计学上显著降低了53%。
关于semaglutide(司美格鲁肽):
semaglutide(中国通用名:司美格鲁肽)是一款人胰高血糖素样肽-1(GLP-1)类似物,以葡萄糖浓度依赖性机制促胰岛素分泌并抑制胰高血糖素分泌,可使2型糖尿病患者血糖水平大幅改善,并且低血糖风险较低。此外,semaglutide还能够通过降低食欲和减少食物摄入量,诱导减肥。除此之外,semaglutide还能够显著降低2型糖尿病患者重大心血管事件(MACE)风险。
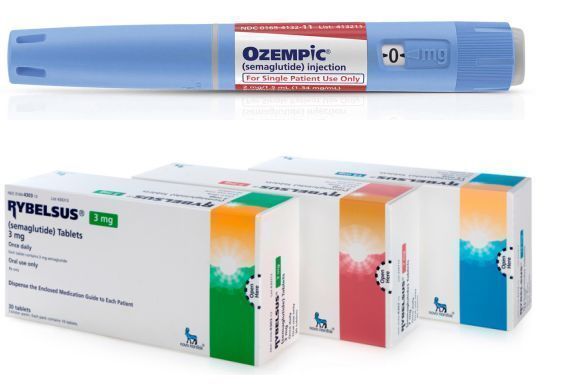
目前,诺和诺德已针对semaglutide开发了注射制剂(Ozempic)和口服制剂(Rybelsus):
——Ozempic(semaglutide,注射制剂):是每周一次的皮下注射制剂(0.5mg或1mg),适用于:(1)作为饮食调整和运动的辅助手段,以改善2型糖尿病成人患者的血糖控制;(2)用于存在心血管疾病(CVD)的2型糖尿病成人患者,降低发生主要不良心血管事件(MACE,包括心血管死亡、非致死性心脏病发作、非致死性卒中)的风险。
Ozempic于2017年12月首次获得美国FDA批准,目前已在全球多个国家和地区上市销售。该药第二个适应症于2020年1月获得美国FDA批准,来自心血管结局试验(CVOT)SUSTAIN 6的数据显示:在心血管(CV)高风险的2型糖尿病患者中,当联合标准护理时,与安慰剂相比,Ozempic将MACE复合终点风险在统计学上显著降低了26%。
——Rybelsus(semaglutide,口服片剂):是一种每日一次的口服制剂,其中含有促进吸收的赋形剂SNAC,该药适用于:作为饮食调整和运动和辅助药物,改善2型糖尿病成人患者的血糖控制。Rybelsus是全球第一款也是唯一一款口服版GLP-1受体激动剂,每日服药一次,治疗剂量有2种:7mg和14mg。
在美国,Rybelsus的标签于2020年1月更新,纳入了证明CV安全性的PIONEER 6 CVOT的额外信息,该试验在CV高风险的2型糖尿病患者中开展,数据显示,当联合标准护理时,与安慰剂相比,Rybelsus达到了复合MACE终点非劣效性的主要终点,证明了CV安全性。研究中,经历了至少一次MACE的患者比例,Rybelsus组为3.8%,安慰剂组为4.8%。

目前,诺和诺德也正在研究每周一次semaglutide 2.4mg皮下注射制剂,作为成人肥胖症的治疗方法。semaglutide可通过减少饥饿感、增加饱腹感,帮助人们吃得更少、减少卡路里的摄入,从而诱导减肥。
本月早些时候,诺和诺德向美国FDA提交了semaglutide 2.4mg皮下注射制剂的新药申请(NDA),该药是一种每周一次的胰高血糖素样肽-1(GLP-1)类似物,用于长期体重管理。值得一提的是,诺和诺德还递交了一张优先审查凭证(PRV)来加速NDA审查,该PRV可将NDA审查周期从标准的10个月缩短至6个月。
semaglutide 2.4mg皮下注射制剂申请的适应症为:作为低热量饮食和加强运动的辅助手段,用于治疗肥胖(BMI≥30kg/m2)或超重(BMI≥27kg/m2)并伴有至少一种体重相关合并症的成人患者。(生物谷Bioon.com)
原文出处:Novo Nordisk to enter phase 3 development in Alzheimer’s disease with oral semaglutide
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


