遗传性血管水肿(HAE)口服疗法!美国FDA批准血浆激肽释放酶抑制剂Orladeyo(berotralstat)!
来源:本站原创 2020-12-06 00:15
Orladeyo用于≥12岁以上人群,预防HAE发作。
HAE发作(图片来源:genassistabcs.com)
2020年12月05日讯 /生物谷BIOON/ --BioCryst制药公司致力于发现新型、口服、小分子药物,用于治疗酶在疾病生物学通路起关键作用、存在显著未满足医疗需求的罕见疾病。近日,该公司宣布,美国食品和药物管理局(FDA)已批准Orladeyo(berotralstat)胶囊剂,这是一种每日口服一次的药物,用于年龄≥12岁的儿童和成人患者,预防遗传性血管水肿(HAE)发作。
值得一提的是,Orladeyo是首个被批准用于预防HAE发作的靶向口服疗法,该药的批准上市将为HAE患者的治疗带来重大进展,将帮助减轻患者的治疗负担。目前,Orladeyo也正在接受欧盟和日本监管机构的审查。
Orladeyo的活性药物成分为berotralstat,这是一种新型、口服、每日一次、强效、选择性人血浆激肽释放酶抑制剂,处于后期临床开发,用于HAE患者,预防和治疗血管水肿发作。
目前,BioCryst公司正在开发berotralstat的2种制剂,胶囊剂开发用于预防HAE发作,口服液体制剂目前处于II期临床开发,用于治疗急性HAE发作。
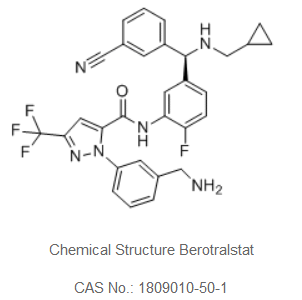
berotralstat化学结构(图片来源:probechem.cn)
在关键3期APeX-2试验中,Orladeyo在治疗第24周时显著减少了HAE发作,并且这种减少持续至第48周。完成48周治疗(150mg)的HAE患者中,HAE发作率在基线检查时为平均每月2.9次发作,治疗48周后降低至平均每月1.0次发作。在长期开放标签APeX-S试验中,完成48周治疗(150mg)的HAE患者,平均每月发作0.8次。
在2项试验中,Orladeyo是安全的,并且耐受性良好。与安慰剂组相比,口服Orladeyo的患者最常报告的不良反应是胃肠道反应。这些反应通常发生在Orladeyo治疗开始后的早期,随着时间的推移变得不那么频繁,并且通常会自行消失。
现有的HAE预防性疗法存在着显著的治疗负担。除了降低HAE发作率外,APeX-2试验的数据显示,在每日一次口服Orladeyo(150mg)的患者中,生活质量和患者总体满意度都有显著改善,每月标准护理按需药物的使用显著减少。
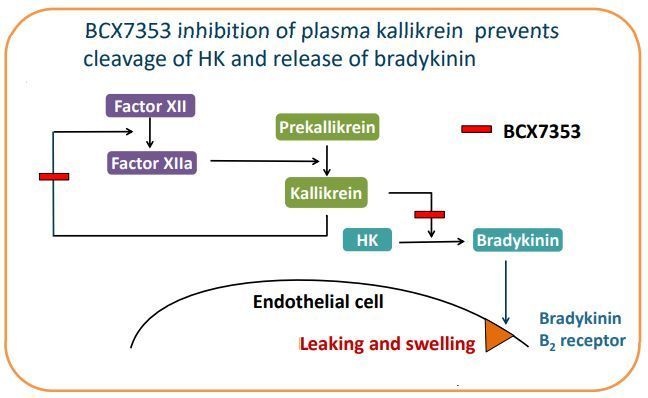
berotralstat作用机制
APeX-2试验的调查员、加州大学圣地亚哥分校遗传性血管水肿协会中心医学教授兼临床主任Marc Riedl表示:“患者和医生都认为,HAE治疗会增加患者的生活负担。 作为一种每天一次的口服治疗方案,Orladeyo可以显著减少发作,并减轻与注射和输液相关的负担。”
美国遗传性血管性水肿协会(HAEA)总裁兼首席执行官Anthony J. Castaldo表示:“Orladeyo的批准上市,将为HAE患者及其医生提供第一个预防HAE发作的口服非甾体药物,这是使医生和患者获得更多治疗选择的重要和受欢迎的一步。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


