首创抗癌药!德琪医药在多个亚太市场提交Xpovio上市申请:治疗骨髓瘤和弥漫性大B细胞淋巴瘤!
来源:本站原创 2020-12-04 18:15
Xpovio是唯一批准的核输出抑制剂(SINE)。

2020年12月04日讯 /生物谷BIOON/ --德琪医药(Antengene)近日宣布,已向新加坡卫生科学局(HSA)、澳大利亚医疗用品管理局(TGA)递交了Xpovio(selinexor, ATG-010)治疗3种适应症的新药上市申请(NDA):(1)用于治疗成人复发难治性多发性骨髓瘤(rrMM)患者,这些患者至少接受过包括2种蛋白酶体抑制剂、2种免疫调节剂和CD38单克隆抗体在内的四线治疗;(2)用于与硼替佐米、地塞米松联合治疗既往接受过至少一线治疗的多发性骨髓瘤患者;(3)用于治疗成人复发难治性弥漫性大B细胞淋巴瘤(rrDLBCL)患者,这些患者既往接受过至少二线治疗的复发难治性弥漫性大B细胞淋巴瘤(包括由滤泡性淋巴瘤转化而来)的疗法。
德琪医药同时向香港卫生署递交了Xpovio的新药上市申请(NDA),用于治疗成人rrMM患者,这些患者至少接受过包括2种蛋白酶体抑制剂、2种免疫调节剂和CD38单克隆抗体在内的四线治疗。
在韩国,Xpovio被授予孤儿药资格,用于治疗成人rrMM患者,这些患者至少接受过包括2种蛋白酶体抑制剂、2种免疫调节剂和CD38单克隆抗体在内的四线治疗,以及用于治疗成人rrDLBCL患者,这些患者既往接受过至少二线治疗的rrDLBCL(包括由滤泡性淋巴瘤转化而来)的疗法。
Xpovio是同类首款且唯一一款口服型选择性核输出抑制剂(SINE),由德琪医药与Karyopharm Therapeutics合作研发。2019年7月,美国食品药品监督管理局(FDA)批准Xpovio联合低剂量地塞米松用于治疗rrMM患者。2020年6月,美国FDA再次批准Xpovio作为单药口服疗法用于治疗rrDLBCL患者。
Xpovio的活性药物成分为selinexor,这是一种首创、口服、选择性核输出抑制剂(SINE)化合物,通过结合并抑制核输出蛋白XPO1(又名CRM1)发挥作用,导致肿瘤抑制蛋白在细胞核内积累,这将重新启动并放大它们的肿瘤抑制功能,导致癌细胞选择性凋亡,同时不会对正常细胞造成显著影响。
值得一提的是,Xpovio是首个也是唯一一个获批的核输出抑制剂(SINE),该药也是自2015年以来首次针对骨髓瘤新靶点(XPO1)的批准药物。此外,Xpovio也是目前被批准用于治疗rrDLBCL的唯一一种单药口服疗法。
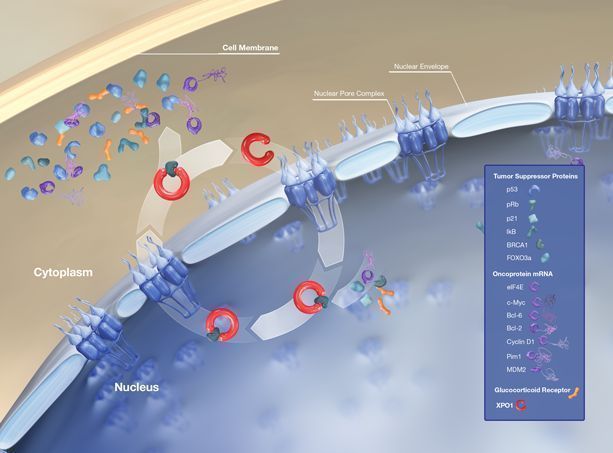
selinexor-XPO1介导核转运
目前,Xpovio二线治疗多发性骨髓瘤的补充新药申请(sNDA)正在接受美国FDA的审查。如果获批,Xpovio将为复发或难治性MM患者的治疗模式提供一个重要的补充。当前,德琪医药和Karyopharm正在多个中后期临床研究中评估selinexor治疗一系列血液系统恶性肿瘤和实体瘤的潜力,包括多发性骨髓瘤(MM)、弥漫性大B细胞淋巴瘤(DLBCL)、脂肪肉瘤(SEAL研究)、子宫内膜癌、复发性胶质母细胞瘤。
2020年11月,德琪医药合作伙伴Karyopharm在2020年结缔组织肿瘤学年会(CTOS 2020)上报告了三期SEAL研究的积极数据,SEAL研究是一项随机、双盲、安慰剂对照交叉研究,旨在比较口服单药Xpovio与安慰剂在脂肪肉瘤患者中的疗效。Karyopharm近期公布了Xpovio用于治疗子宫内膜癌患者的三期SIENDO研究已通过计划的中期无效性分析。同时,数据安全监查委员会(DSMB)推荐SIENDO研究无需作任何修改按计划继续进行,SIENDO试验的顶线数据预计在2021年下半年公布。(生物谷Bioon.com)
原文出处:Karyopharm Therapeutics/Antengene submits applications for Xpovio in Asia-Pacific region for blood cancer
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


