黑色素瘤相关研究进展
来源:本站原创 2020-10-27 23:27
本期为大家带来的是黑色素瘤相关领域的研究进展,希望读者朋友们能够喜欢。
2020年10月27日 讯 /生物谷BIOON/ --本期为大家带来的是黑色素瘤相关领域的研究进展,希望读者朋友们能够喜欢。

1. Nature Medicine解读!黑色素瘤如何欺骗宿主机体的免疫系统增加其对化疗的耐受性?
doi:10.1038/s41591-020-1073-3
复杂的人类免疫系统会进化成为一种有效的保护系统来抵御多种疾病的发生,比如癌症等,而免疫系统能利用一种名为“免疫监视”的监控过程来识别并摧毁癌细胞;然而,免疫系统有时候会呈现另外一种个性,从而促进肿瘤形成发展而并非破坏癌细胞,这种双重行为就会使得诊断预后标志和药物开发变得非常困难,实际上,肿瘤学研究中研究人员所面临的挑战之一就是如何开发更好且更为有效的免疫疗法。
近日,一篇刊登在国际杂志Nature Medicine上题为“Midkine rewires the melanoma microenvironment toward a tolerogenic and immune-resistant state”的研究报告中,来自西班牙国立癌症研究中心等机构的科学家们通过研究揭示了黑色素瘤细胞是如何不让宿主机体免疫系统检测并发现的,从而宿主免疫系统就不会攻击黑色素瘤细胞,并将其转变为盟友的;相关研究结果具有非常重要的临床意义,其有望应用到其它类型的癌症研究中。
2017年,研究人员通过研究发现,名为MIDKINE的蛋白在黑色素瘤转移过程中扮演着非常关键的角色,以至于该蛋白的激活能够决定肿瘤发生转移的潜力;实际上,黑色素瘤发生早期转移的可能性非常大,为此,研究人员还在新型动物模型中分析了MIDKINE蛋白的表达,结果发现,MIDKINE的高水平表达与其拥有的高度转移潜能存在直接关联,而阻断MIDKINE的功能或会抑制癌细胞的扩散;本文研究中,研究人员又取得了新的发现,即他们发现了MIDKINE蛋白在宿主免疫系统所扮演的新型角色,其并不会攻击黑色素瘤细胞, 反而会促进炎症和黑色素瘤的生长。随后研究人员分析了来自六项独立研究的数据库,发现了一组基因与对免疫疗法没有反应或产生耐药性的患者机体中MIDKINE蛋白的表达直接相关。
研究人员在动物模型中检测了这些观察性结果,研究者Soengas表示,当我们阻断MIDKINE蛋白的表达时,两种重要的免疫细胞:巨噬细胞和T淋巴细胞又开始正常发挥作用并开始攻击肿瘤了;这就意味着,在治疗黑色素瘤患者方面,我们应该采用一种双重治疗手段,踩住免疫反应的刹车踏板,也就是利用免疫检查点抑制剂显然是不够的,MIDKINE蛋白也应该被抑制,这样机体的免疫防御系统才能够恢复正常的功能。同时研究人员还对其它类型的肿瘤进行了研究,比如胶质瘤、肺癌和肾脏癌症等,他们相信这些研究结果对很多疾病未来的治疗都能产生相当大的影响。
近些年来,研究人员和临床医生在如何增强机体免疫细胞抵御癌症能力上做出了相当大的努力,然而即使在某些情况下,免疫疗法的治疗也非常成功,但这种方法还需要进一步发展,比如,比如实际上,免疫疗法在治疗胰腺癌上似乎并不太成功,而在治疗黑色素瘤上,大约60%的患者会对疗法产生反应。肿瘤对免疫疗法反应的差异会导致肿瘤被分类为“热性”或“冷性”,一些“热性”对疗法并不会完全产生反应,而这是研究人员之前无法解释的事实,本文研究结果有望帮助研究人员解释为何会发生这种现象,这或许有助于帮助增加免疫疗法在治疗这些肿瘤上的有效性。
2. Clin Cancer Res:一种特殊的新型工具有望帮助抵御黑色素瘤
DOI:10.1158/1078-0432.CCR-20-2251
近日,一项刊登在国际杂志Clinical Cancer Research上的研究报告中,来自伊迪斯科文大学等机构的科学家们通过研究发现了一种癌症关键的血液标志物,其或能帮助科学家们选择最有效的黑色素瘤疗法,相关研究结果或能帮助改善黑色素瘤患者的生存率。
研究者发现,携带高水平ctDNA(circulating tumour DNA)的患者或许会因抵御黑色素瘤的有效疗法而潜在获益,ctDNA是一种指示癌症的重要血液标志物;相关研究发现或许还能帮助临床医生有效开发新型的黑色素瘤疗法。研究者Gray说道,选择合适的药物和疗法来治疗黑色素瘤非常繁琐且复杂,而且需要依赖于一系列因素,包括肿瘤的特征及其如何在全身扩散等。

生物标志物或能帮助临床医生更好地确定如何采用组合性疗法治疗的话哪些患者能够获得更好的治疗结局;当然了,本文研究结果还需要后期更为深入的研究才能够证实,同时研究者还需要仔细考虑如何在黑色素瘤疗法决策制定中使用生物标志物;最重要的是他们需要知道何时应该使用特定药物来靶向作用癌症,以及哪些患者会受益更多,因为积极性的治疗手段常常会产生更为严重的治疗副作用。同时本文研究还能帮助临床医生基于特殊的疾病特征和患者来制定个体化的疗法策略。
研究者发现,ctDNA生物标志物或许并不能帮助预测使用免疫疗法作为二线治疗的黑色素瘤患者的治疗结局,此前研究则表明,在一线疗法治疗前,这种生物标志物能帮助更好地预测患者的生存率。由于ctDNA能被用来指示患者对靶向性第一轮黑色素瘤疗法所产生的反应,但如今他们却发现其不能预测患者接受二线治疗后的生存率,这就意味着临床医生或许会使用其它手段来确定是否该疗法能够成功治疗黑色素瘤患者。
本文研究基于科学家们对血液中癌症生物标志物的调查(俗称为液体活检)基础,对这些生物标志物的研究对于理解癌症如何在机体中扩散至关重要;深入分析关键的生物标志物或许也能帮助解锁更有效的治疗方法。研究者表示,如今我们正在寻找新型药物和疗法来治疗黑色素瘤,但如果我们发现证据表明特定药物能对携带某种特性的肿瘤发挥作用的话,这或许就能帮助他们利用当前的药物来进行更具靶向性地精确治疗。
目前研究人员正在深入研究对疗法产生耐药性的黑色素瘤的特性,并阐明为何二线疗法无法有效治疗黑色素瘤;此外本文研究还提出了很多问题,研究人员还想知道到底是什么样的机制让肿瘤变得不同、以及对疗法产生一定的耐药性。
3. Nature:测量单个皮肤细胞中积累的DNA突变可预测黑色素瘤风险
doi:10.1038/s41586-020-2785-8.
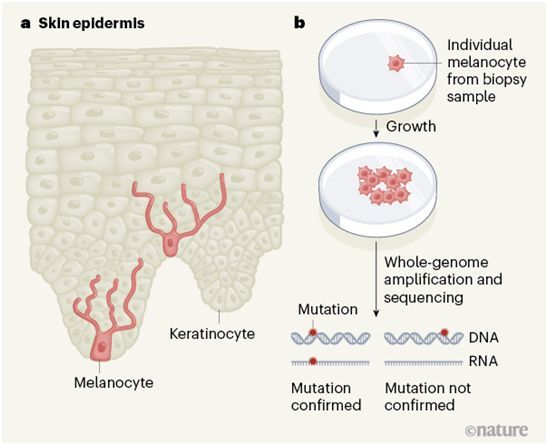
根据一项新的检测单个皮肤细胞中DNA突变的研究,来自美国加州大学旧金山分校和犹他大学的研究人员指出,早在发现任何可疑的痣之前,就可以估计最致命的皮肤癌---黑色素瘤---的风险。相关研究结果近期发表在Nature期刊上,论文标题为“The genomic landscapes of individual melanocytes from human skin”。
阳光造成的皮肤损伤会随着时间的推移而积累,但往往是肉眼不可见的。然而,皮肤细胞内的DNA也会在多年的太阳紫外线照射下积累损伤,这种损伤是可以测量的。
论文通讯作者、加州大学旧金山分校皮肤科助理教授A.Hunter Shain博士表示,这项研究中开发的检测皮肤损伤的基因组方法可用于估计普通人群中个体的基线黑色素瘤风险,并对皮肤科医生应该多久对某人进行一次癌症筛查提出建议。
Shain说,“事实证明,所谓正常的皮肤中的许多细胞充满了与黑色素瘤相关的突变,这些突变是阳光照射的结果。黑色素瘤通常仅在几十年的突变损伤积累后才会出现,但有些人的风险比其他人更大。有了我们开发的技术,那些积累突变最多的人可以被更密切地监测,并可以寻求更好地保护自己免受阳光照射。”
黑色素瘤产生于一种称为黑素细胞(melanocyte)的皮肤细胞中。黑素细胞制造黑色素,从而有助于保护包括大量存在的角质细胞在内的皮肤细胞免受阳光损伤。但是。当DNA损伤导致黑素细胞生长失控时,黑素细胞面临着最大的风险。
根据美国癌症协会的统计,黑色素瘤的发病率正在上升。2020年,美国约有10万人将被诊断为黑色素瘤,约有6850人死于这种癌症。白人一生患黑色素瘤的风险约为38分之1,黑人约为1000分之1,西班牙裔约为167分之1。黑色素瘤在早期发现时可以通过手术切除,但一旦扩散就很难治疗。
在这项研究中,这些作者一次一个细胞地对皮肤样本中的黑色细胞DNA进行测序,统计突变情况,重点是少数促进黑色素瘤出现和生长的突变。这些皮肤样本来自六个人:两个黑色素瘤幸存者和四个从未患过黑色素瘤的人的尸体。所有的人都是白人。这些作者分析了来自背部、头部、腿部、肩部、臀部和脚部的共133个黑素细胞的DNA。
这些作者发现,相比于从未患过黑色素瘤的人的皮肤中的黑素细胞,来自前癌症患者黑色素瘤附近的正常皮肤的黑素细胞有显著更多的突变,包括黑色素瘤相关的突变。
Shain说,有很多痣的人仍然应该接受筛查,但只有30%的黑色素瘤产生于已经存在的痣。
Shain说,“黑色素瘤真地可以凭空出现。我们在这项研究中发现,正常皮肤中含有很多已表现出一些癌症相关突变的黑素细胞。从本质上讲,我们发现了70%的黑色素瘤前体并不是由先前存在的痣产生的。”
Shain说,虽然更多的阳光照射会导致更高的风险,但这种相关性是复杂的,这还与肤色、固有的DNA修复能力和其他因素有关。儿童时期的晒伤可能比成年时期的职业暴露(如户外工作)带来更大的风险。Shain说,“测量突变可能是一种衡量所有这些变量对黑色素瘤风险的净影响的好方法。”
奇怪的是,与长期暴露在阳光下的区域(如面部)相比,黑色素瘤更经常发生在皮肤的间歇性暴露区域,如背部或大腿。与这一规律相一致的是,Shain的研究团队发现背部和四肢中的黑素细胞发生的突变比头颈部皮肤中的更多。
Shain说,这项研究中进行的单细胞分析使得人们能够关注皮肤中相对稀疏的黑素细胞,并识别出具有癌前突变的细胞,不过完成这一目标需要将新的技术方法组合在一起。
由于与包含众多细胞的典型生物样本相比,单个细胞中的DNA数量太少,因此必须对DNA进行扩增以获得足够的数量。用于扩增DNA的酶会引入错误,但Shain团队使用了额外的实验室方法来更好地区分扩增错误和真正的突变,并开发了计算机算法来进一步提高这种分析的准确性。
Shain说,“我们期待,这些方法的精简、自动化版本有朝一日将广泛用于测量黑色素瘤的风险,并可作为癌症筛查建议的基础。”
4. Cancer Immunol Res:识别出开发新型黑色素瘤疗法的新型潜在靶点
DOI:10.1158/2326-6066.CIR-19-0894
日前,一项刊登在国际杂志Cancer Immunology Research上的研究报告中,来自莫纳什大学等机构的科学家们通过研究在黑色素肿瘤表达发现了特殊的新型标志物—HLA相关的肽类,相关研究结果会有望帮助研究人员开发新型疫苗来抵御黑色素瘤的发生。
尽管当前科学家们在黑色素瘤疗法上取得了多项研究进展,但每隔5个小时仍然会有1名澳大利亚黑色素瘤患者因为没有得到有效的治疗而发生死亡,一种新型的疗法能通过识别在肿瘤细胞表面装饰的小型肿瘤特殊蛋白片段(肽类),来调节机体自身的免疫系统从而帮助检测并杀灭肿瘤细胞,文章中研究人员成功在黑色素瘤肿瘤表面识别了数千个特殊肽类,这些肽类能被宿主机体免疫系统所识别。
相关研究结果产生了快速的临床应用价值,目前研究人员正在联合研究利用一种拼接肽类对黑色素瘤患者进行临床接种试验;研究者Woods指出,黑色素瘤会在不同的生长状况下密切监视宿主机体的免疫系统,我们在这项研究中发现的多种黑色素瘤肽类是此前很多研究并未报道过的,这既让人惊讶又令人激动。研究结果表明,一些黑色素瘤肽类标志物能通过一种剪接过程来产生,在剪接过程中,蛋白质首先会被切割成为小片段肽类,随后两个片段会被粘贴在一起形成一种“拼接肽”(spliced peptide),通过识别具体的剪接肽类,其就能够在体外进行合成,随后输注到患者体内诱发免疫系统来识别并靶向作用特殊的肿瘤。
研究者的目的就是寻找开发新型黑色素瘤疗法的靶点,此前他们并不知道这些特殊拼接肽的存在、流行和重要性,也并不清楚其是否会被机体免疫系统所识别,如今研究人员发现了这些拼接肽,他们希望利用这些拼接肽作为诱饵来诱发宿主机体免疫系统发挥作用。研究者Andreas Behren指出,本文研究发现让我们非常兴奋,如今我们能够在不同免疫原性的患者体内识别特殊的黑色素瘤拼接肽分子了;基于此前研究结果,如今拼接肽抗原已经从原来免疫学研究中的好奇点转变成为一种全新的可操作靶点了,这不仅在黑色素瘤研究中如此,在其它癌症研究领域中也是如此;基于研究人员开发的新型工作流,如今他们就能识别出此前被忽略的多肽分子,这或许为后期免疫疗法和新型癌症疫苗的开发奠定了一定的基础,事实上,这种剪接过程的普遍性指向了一类特殊的抗原,其在感染性疾病、自身免疫性疾病和过敏性疾病的发生过程中都扮演着关键角色。
5. Cancer Cell:揭示干扰素γ引导黑色素瘤患者对癌症免疫疗法产生反应的分子机制
DOI:10.1016/j.ccell.2020.08.005
近日,一项刊登在国际杂志Cancer Cell上的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究揭示了干扰素γ(IFN-γ)引导恶性黑色素瘤患者疗法反应的分子机制,这些患者均采用了免疫检查点阻滞剂进行治疗,IFN-γ是一种能帮助激活宿主机体免疫细胞功能的免疫反应刺激信号分子。
研究者指出,帮助维持免疫系统功能的两种主要驱动子或能帮助有效攻击癌症,T细胞在肿瘤中浸润的水平源于免疫检查点阻滞剂的释放和下游相应干扰素γ的信号传导,阻断此前被认为能限制对癌细胞攻击作用的免疫检查点或能驱动干扰素γ的信号表达,从而就能放大机体的抗肿瘤免疫反应,进而诱发癌症免疫疗法所诱导的临床反应。
研究者Antoni Ribas说道,我们研究发现,当抵御癌症的预先免疫反应被放大时,免疫检查点阻滞疗法就能发挥作用,癌细胞能通过免疫检查点(CTLA-4和PD-1)来阻断免疫系统攻击癌细胞的方式,无论何时何时释放免疫检查点,免疫激活的增加都依赖于T细胞产生免疫激活细胞因子—干扰素γ的强度,其会导致超过600个基因被激活,进而放大机体的抗肿瘤免疫反应。如今,尽管科学家们在癌症免疫疗法研究上取得了巨大的成功,该疗法能利用宿主机体的免疫系统来更好地攻击癌细胞,但仅有一小部分患者会获益;于是研究人员就想继续通过研究来调查并利用基因组测序等技术更好地理解免疫检查点阻滞对癌症患者的作用效果以便能够克服局限性,并将疗法扩展到更多患者的治疗过程中去。
这项研究中,研究人员对接受抗PD-1抗体纳武单抗、纳武单抗和抗CTLA-4抗体易普利姆玛联合疗法的101名黑色素瘤患者进行研究,他们在DNA和RNA水平下分别对这些患者机体的黑色素瘤组织进行基因组测序来分析基线和治疗时的活组织特性,纳武单抗和易普利姆玛是两种癌症免疫疗法药物;在参与者治疗前和治疗中,研究者观察其机体肿瘤组织特性的改变来分析表现出临床反应和未表现出临床反应的患者机体中基因的表达情况,这或许就能让研究者观察到随着时间延续患者机体免疫反应发生改变的机制,同时还能重点分析当免疫系统处于活跃状态时癌细胞是如何启动基因进行表达的,随后研究者发现了干扰素γ基因,他们指出,通过开启或关闭一系列基因的表达来对干扰素γ产生反应的能力在绝大多数癌细胞中都能被保存下来。
最后研究者表示,后期他们还将继续深入研究来分析干扰素γ基因,并以此作为一种新方法来预测患者对免疫疗法所产生的反应,同时研究者还想寻找一种新型的组合性疗法来诱导干扰素信号的传导,并应用于更多癌症患者的治疗。
6. Advanced Therapeutics:新型纳米系统有效治疗黑色素瘤
DOI: 10.1002/adtp.202070017
在最近一项研究中,特拉维夫大学萨克勒医学院TAU生理学和药理学系的Ronit Satchi-Fainaro教授等人开发了一种创新的纳米技术给药系统,该系统显著提高了侵袭性皮肤癌黑色素瘤的治疗效果。
纳米载体是生物相容性和可生物降解的聚合物,其包含谷氨酸的重复单元。它把两种已被证实具有治疗黑色素瘤功效的不同家族的药物包装在一起:BRAF抑制剂(Dabrafenib)和MEK抑制剂(Selumetinib,已批准用于I型神经纤维瘤病患儿)。
该论文近日在《Advanced Therapeutics》杂志上发表。
Satchi-Fainaro教授说:“生物治疗的主要障碍之一是一段时间后癌细胞对药物产生了抗药性。我们认为,通过精确递送两种或多种靶向药物,可以从不同方向同时并有力地攻击癌细胞,我们可以延迟甚至阻止获得这种耐药性。”
“当今大多数肿瘤治疗都是以几种药物的混合物形式进行的。但是,即使药物是同时给药的,但由于基本参数的不同(例如它们在肿瘤中存活的时间长短),它们不能同时到达肿瘤。血流和每种药物到达肿瘤组织所花费的时间。因此,在大多数情况下,药物不能同时起作用,从而阻止了它们获得最佳的协同活性。”
为应对这些问题,研究人员开发了一种创新,高效且可生物降解的药物输送系统。选择了两种已知对黑色素瘤有效的药物:达布拉非尼和塞鲁米替尼,使用纳米载体将它们共同递送至肿瘤。选择用于该任务的药物纳米载体叫做PGA,一种谷氨酸的。该纳米载体是几年前在Satchi-Fainaro教授的实验室中开发,已经成功测试了在动物模型中治疗胰腺癌,乳腺癌和卵巢癌的能力。
研究人员首先根据毒性的水平和类型以及癌细胞对每种药物产生的耐药机制确定了两种药物之间的最佳比例。最终将确保最大的效力,最小的毒性和最佳的协同活性。关节给药的另一个重要优点是减少剂量:与每种药物相比,单独给药时所需的剂量要低得多。
下一步是使用化学修饰使聚合物载体与所选药物之间交联。该组合系统可以完全安全地在体内传播,不会对健康组织造成损害。到达癌细胞后,纳米载体会遇到组织蛋白酶酶家族的蛋白,该蛋白在恶性肿瘤中被高度激活。蛋白质降解聚合物,释放出变得活跃的药物并联合起来攻击肿瘤。
小鼠黑色素瘤模型上的测试结果表明其令人鼓舞的结果。纳米载体能够将两种药物递送至肿瘤,并同时将其释放到体内,到达肿瘤部位的有效剂量是分别递送药物的约20倍。另外,与对照组和用游离药物治疗的组相比,由纳米载体递送的药物实现的治疗效果持续时间长两倍至三倍。
根据研究人员的说法,新平台可以实现更低的剂量,约为常规药物鸡尾酒所需剂量的三分之一。总体而言,治疗也更安全,更有效。如有必要,新方法所允许的剂量要远远高于当前方法所允许的最大剂量,从而进一步提高治疗效果。
7. JID:研究揭示BRAF耐受性黑色素瘤恶化机制
DOI:doi.org/10.1016/j.jid.2020.08.012
BRAF-MEK抑制剂的靶向治疗是针对无法手术切除或扩散到身体其他部位的晚期黑色素瘤患者的有效治疗方法。但是,许多患者对该疗法产生抵抗力,这通常会导致进一步的转移。莫菲特癌症中心的研究人员帮助开发了这种联合疗法,目前正在努力更好地了解导致这种抗药性的原因,以期希望找到解决方法。
在《Journal of Investigative Dermatology》上发表的一篇新文章中,Moffitt研究人员确定了促红细胞生成素产生的肝细胞受体A2(EphA2)是黑色素瘤转移和BRAF-MEK抑制剂耐药的驱动因素。
EphA2是一种酪氨酸激酶受体,有助于在正常细胞中维持稳定的环境。但是,EphA2在许多癌症中通常过表达,并在其生长中起关键作用。它的确切功能取决于信号传导途径:经典的和非经典的。经典途径抑制癌细胞增殖并充当肿瘤抑制剂。非经典途径具有相反的作用,促进肿瘤存活和转移。
Moffitt团队与Sanford Burnham Prebys医学发现研究所的科学家合作,致力于EphA2的非经典途径。研究人员使用基于质谱的综合蛋白质组学技术,绘制了由非经典EphA2驱动的信号网络,发现该信号可增强癌细胞转移潜力。
该研究小组通过使用经非经典途径EphA2-S897E转导的黑色素瘤细胞建立小鼠模型,进一步证实了这一发现,并发现向肺部转移的数量明显更高。
Keiran Smalley博士说:“我们希望对导致BRAF和BRAF-MEK抑制剂治疗产生耐药性以及进一步转移的原因有了更好的了解,将使我们能够更好地了解治疗逃逸的过程,并为黑素瘤患者制定新的治疗策略。”
8. Clin Cancer Res:科学家识别出治疗黑色素瘤免疫疗法的新型潜在靶点
DOI:10.1158/1078-0432.CCR-19-3925
近日,一项刊登在国际杂志Clinical Cancer Research上的研究报告中,来自QIMR Berghofer医学研究所等机构的科学家们通过研究揭示了为何某些黑色素瘤患者对免疫疗法反应不佳,相关研究结果或能帮助研究者开发治疗潜在致死性癌症的新型靶向性疗法。
澳大利亚是全球黑色素瘤发病率最高的国家,澳大利亚健康和福利研究所估计,去年澳大利亚就有超过1.5万人被诊断为黑色素瘤,而且有1700多人死亡。这项研究中,研究者发现,人类黑色素瘤细胞中名为CD155的特殊蛋白或会让皮肤癌更难以利用免疫疗法进行治疗,研究者揭示了CD155对于转移性黑色素瘤患者进行免疫治疗有效性的重要性,而这在人类机体中此前并未发现过。

肿瘤似乎会利用CD155分子来躲避免疫T细胞的追捕,同时还能抵御免疫疗法的杀伤;CD155蛋白能在几乎所有癌细胞中进行表达,但在正常细胞中表达地较少,包括某些免疫细胞等,其是对于细胞间相互作用非常重要的粘连蛋白家族中的一部分。研究者Smyth表示,当前的免疫疗法能成功帮助解开免疫系统的束缚来杀灭黑色素瘤细胞,但在某些患者体内,肿瘤细胞仍然会隐藏起来使得疗法无效,最终引发患者死亡。黑色素瘤细胞中高水平的CD155似乎能帮助肿瘤躲避T细胞的检测,并能欺骗T细胞不去触碰肿瘤,在相互作用期间,肿瘤的CD155似乎会损伤T细胞,降低其识别并杀灭肿瘤细胞的能力,而减少转移性黑色素瘤患者机体中的肿瘤CD155的水平则能作为一种新方法来改善免疫疗法的治疗效率,并能挽救更多患者的生命。
文章中,研究人员利用新型成像技术分析了收集自患者机体的疗法前肿瘤样本,随后他们将肿瘤CD155的水平与患者的预后联系起来,研究者表示,成像结果显示黑色素瘤中存在高水平的CD155,而且携带高水平CD155的患者往往健康状况较差,而且对免疫疗法并没有反应;因此,CD155的水平或会使得癌细胞出现免疫逃避现象,而T细胞无法杀灭肿瘤是因为CD155蛋白会使得T细胞失衡,并在其发挥作用前关闭其功能;目前并没有针对黑色素瘤的治疗性手段能靶向作用CD155,因此研究者就希望深入研究开发出新型免疫疗法来靶向作用CD155蛋白,从而抑制肿瘤的发展。
本文研究基于研究者2018年的一项研究,该研究表明,肿瘤和免疫细胞中的CD155对于肿瘤的生长和扩散至关重要,后期研究者希望能通过更为深入的研究来分析是否CD155在其它癌症对免疫疗法的反应过程中扮演着关键角色。
9. Nat Cancer:为何男性在遗传上更易患黑色素瘤?
doi:10.1038/s43018-020-0077-8
随着今年夏季对COVID-19疫情限制的放宽,将会有越来越多的加拿大人有时间呆在户外充分享受阳光给其带来的欢悦;近日,一项刊登在国际杂志Nature Cancer上的研究报告中,来自麦吉尔大学等机构的科学家们通过研究揭示了为何男性更易在遗传上患上皮肤癌。文章中,研究人员在X染色体上识别出了三个携带明显突变的基因,女性拥有两个X染色体,而男性则拥有一个X染色体和一个Y染色体,研究人员在X染色体上所发现的三个明显突变的基因中,仅有一个基因拥有仅在男性机体中存在的特殊突变类型。
女性则会在其它问题基因上发育出其它类型的突变,但由于其拥有两个X染色体(男性仅有一个X染色体),因此其就拥有基因的两个拷贝,当其中一个拷贝发生突变时,另一个拷贝还能作为备份,这些突变或许就能帮助研究人员解释为何男性黑色素瘤患者的癌症发病率更高,而且存活率也更低。
引发黑色素瘤最重要的风险因素之一就是来自太阳和室内美黑的紫外线,通过解释紫外线暴露所引发的特殊遗传突变,科学家们在基因测序技术上的进步就能帮助其深度解析黑色素瘤性别差异背后的原因,这项研究中,研究人员分析了超过一千多例黑色素瘤患者病例,解释了人类在患黑色素瘤风险上的性别差异,后期研究人员将会继续深入研究,其中包括确定这些突变如何影响黑色素瘤的生物学特性以及患者如何对免疫疗法产生反应。
研究者Watson教授说道,免疫疗法给很多黑色素瘤患者的治疗带来了革命性的变革,其能重新激活患者体内的免疫系统来帮助清除机体内的癌细胞;然而不幸的是,大量的患者并不会对该疗法产生反应,因此研究人员就需要联合深入研究理解背后的分子机理,从而开发出有效的抗癌策略。
除了性别差异在黑色素瘤不同发病率和患者存活率上扮演的关键角色外,如今越来越多的数据也表明,不同性别的个体或许对最新的疗法也会产生不同的反应;目前研究人员正在调查他们所揭示的基因突变中的性别差异是否能够帮助解释上述原因,加深研究人员对多种黑色素瘤亚型遗产特性的了解,或能帮助研究人员开发出新型个体化抗癌疗法,从而让患者与疗法相匹配来更加有效地对患者进行治疗。
10. Allergy:抗组胺药物可用于治疗恶性黑色素瘤
DOI: 10.1111/all.14273
一种非常常见的过敏药能否改善患有严重皮肤癌,恶性黑色素瘤的患者的生存率?瑞典隆德大学的一项发表在《Allergy》杂志上的新研究表明可能确实如此。
文章作者霍坎·奥尔森教授强调:“以前的研究表明,抗组胺药对于乳腺癌患者的生存而言具有益处。如今在恶性黑色素瘤患者中也有同样的发现。但是,需要更多的研究来证实结果。”
在这项研究中,研究人员分析了被诊断为恶性黑色素瘤患者中使用六种抗组胺药:氯雷他定,西替利嗪,氯雷他定,clemastine,依巴斯汀和非索非那定的情况及其治疗效果。

作者收集了来自于三个大型机构,总计24562人的信息。在这些人中,有1,253位是抗组胺药使用者。最常用的地氯雷他定(395)西替利嗪(324),氯雷他定(251)或clemastine(192)。其他抗组胺药的使用人数则少得多。
“与未使用抗组胺药的人进行比较时,我们观察到了使用去氯雷他定的人存活率有所提高,尤其是在65岁及65岁以上的人群中。其他抗组胺药的使用没有明显的生存效果。 ,此外,去氯雷他定和氯雷他定的使用似乎也减少了患新的恶性黑色素瘤的风险,”作者说道。
“这一发现对于将来的抗黑色素瘤药物的开发可能具有一定的借鉴意义。此外,这些药物几乎没有副作用。”
该研究小组现正计划进行动物实验以了解其背后的机制,适当的剂量和最佳治疗期。
“我们正在与巴塞罗那和斯德哥尔摩的研究人员合作。在隆德,我们正在进行动物和人类受试者的研究,其中将评估抗组胺药的治疗效果,” 奥尔森教授总结道。(生物谷Bioon.com)

1. Nature Medicine解读!黑色素瘤如何欺骗宿主机体的免疫系统增加其对化疗的耐受性?
doi:10.1038/s41591-020-1073-3
复杂的人类免疫系统会进化成为一种有效的保护系统来抵御多种疾病的发生,比如癌症等,而免疫系统能利用一种名为“免疫监视”的监控过程来识别并摧毁癌细胞;然而,免疫系统有时候会呈现另外一种个性,从而促进肿瘤形成发展而并非破坏癌细胞,这种双重行为就会使得诊断预后标志和药物开发变得非常困难,实际上,肿瘤学研究中研究人员所面临的挑战之一就是如何开发更好且更为有效的免疫疗法。

近日,一篇刊登在国际杂志Nature Medicine上题为“Midkine rewires the melanoma microenvironment toward a tolerogenic and immune-resistant state”的研究报告中,来自西班牙国立癌症研究中心等机构的科学家们通过研究揭示了黑色素瘤细胞是如何不让宿主机体免疫系统检测并发现的,从而宿主免疫系统就不会攻击黑色素瘤细胞,并将其转变为盟友的;相关研究结果具有非常重要的临床意义,其有望应用到其它类型的癌症研究中。
2017年,研究人员通过研究发现,名为MIDKINE的蛋白在黑色素瘤转移过程中扮演着非常关键的角色,以至于该蛋白的激活能够决定肿瘤发生转移的潜力;实际上,黑色素瘤发生早期转移的可能性非常大,为此,研究人员还在新型动物模型中分析了MIDKINE蛋白的表达,结果发现,MIDKINE的高水平表达与其拥有的高度转移潜能存在直接关联,而阻断MIDKINE的功能或会抑制癌细胞的扩散;本文研究中,研究人员又取得了新的发现,即他们发现了MIDKINE蛋白在宿主免疫系统所扮演的新型角色,其并不会攻击黑色素瘤细胞, 反而会促进炎症和黑色素瘤的生长。随后研究人员分析了来自六项独立研究的数据库,发现了一组基因与对免疫疗法没有反应或产生耐药性的患者机体中MIDKINE蛋白的表达直接相关。
研究人员在动物模型中检测了这些观察性结果,研究者Soengas表示,当我们阻断MIDKINE蛋白的表达时,两种重要的免疫细胞:巨噬细胞和T淋巴细胞又开始正常发挥作用并开始攻击肿瘤了;这就意味着,在治疗黑色素瘤患者方面,我们应该采用一种双重治疗手段,踩住免疫反应的刹车踏板,也就是利用免疫检查点抑制剂显然是不够的,MIDKINE蛋白也应该被抑制,这样机体的免疫防御系统才能够恢复正常的功能。同时研究人员还对其它类型的肿瘤进行了研究,比如胶质瘤、肺癌和肾脏癌症等,他们相信这些研究结果对很多疾病未来的治疗都能产生相当大的影响。
近些年来,研究人员和临床医生在如何增强机体免疫细胞抵御癌症能力上做出了相当大的努力,然而即使在某些情况下,免疫疗法的治疗也非常成功,但这种方法还需要进一步发展,比如,比如实际上,免疫疗法在治疗胰腺癌上似乎并不太成功,而在治疗黑色素瘤上,大约60%的患者会对疗法产生反应。肿瘤对免疫疗法反应的差异会导致肿瘤被分类为“热性”或“冷性”,一些“热性”对疗法并不会完全产生反应,而这是研究人员之前无法解释的事实,本文研究结果有望帮助研究人员解释为何会发生这种现象,这或许有助于帮助增加免疫疗法在治疗这些肿瘤上的有效性。
2. Clin Cancer Res:一种特殊的新型工具有望帮助抵御黑色素瘤
DOI:10.1158/1078-0432.CCR-20-2251
近日,一项刊登在国际杂志Clinical Cancer Research上的研究报告中,来自伊迪斯科文大学等机构的科学家们通过研究发现了一种癌症关键的血液标志物,其或能帮助科学家们选择最有效的黑色素瘤疗法,相关研究结果或能帮助改善黑色素瘤患者的生存率。
研究者发现,携带高水平ctDNA(circulating tumour DNA)的患者或许会因抵御黑色素瘤的有效疗法而潜在获益,ctDNA是一种指示癌症的重要血液标志物;相关研究发现或许还能帮助临床医生有效开发新型的黑色素瘤疗法。研究者Gray说道,选择合适的药物和疗法来治疗黑色素瘤非常繁琐且复杂,而且需要依赖于一系列因素,包括肿瘤的特征及其如何在全身扩散等。

生物标志物或能帮助临床医生更好地确定如何采用组合性疗法治疗的话哪些患者能够获得更好的治疗结局;当然了,本文研究结果还需要后期更为深入的研究才能够证实,同时研究者还需要仔细考虑如何在黑色素瘤疗法决策制定中使用生物标志物;最重要的是他们需要知道何时应该使用特定药物来靶向作用癌症,以及哪些患者会受益更多,因为积极性的治疗手段常常会产生更为严重的治疗副作用。同时本文研究还能帮助临床医生基于特殊的疾病特征和患者来制定个体化的疗法策略。
研究者发现,ctDNA生物标志物或许并不能帮助预测使用免疫疗法作为二线治疗的黑色素瘤患者的治疗结局,此前研究则表明,在一线疗法治疗前,这种生物标志物能帮助更好地预测患者的生存率。由于ctDNA能被用来指示患者对靶向性第一轮黑色素瘤疗法所产生的反应,但如今他们却发现其不能预测患者接受二线治疗后的生存率,这就意味着临床医生或许会使用其它手段来确定是否该疗法能够成功治疗黑色素瘤患者。
本文研究基于科学家们对血液中癌症生物标志物的调查(俗称为液体活检)基础,对这些生物标志物的研究对于理解癌症如何在机体中扩散至关重要;深入分析关键的生物标志物或许也能帮助解锁更有效的治疗方法。研究者表示,如今我们正在寻找新型药物和疗法来治疗黑色素瘤,但如果我们发现证据表明特定药物能对携带某种特性的肿瘤发挥作用的话,这或许就能帮助他们利用当前的药物来进行更具靶向性地精确治疗。
目前研究人员正在深入研究对疗法产生耐药性的黑色素瘤的特性,并阐明为何二线疗法无法有效治疗黑色素瘤;此外本文研究还提出了很多问题,研究人员还想知道到底是什么样的机制让肿瘤变得不同、以及对疗法产生一定的耐药性。
3. Nature:测量单个皮肤细胞中积累的DNA突变可预测黑色素瘤风险
doi:10.1038/s41586-020-2785-8.

根据一项新的检测单个皮肤细胞中DNA突变的研究,来自美国加州大学旧金山分校和犹他大学的研究人员指出,早在发现任何可疑的痣之前,就可以估计最致命的皮肤癌---黑色素瘤---的风险。相关研究结果近期发表在Nature期刊上,论文标题为“The genomic landscapes of individual melanocytes from human skin”。
阳光造成的皮肤损伤会随着时间的推移而积累,但往往是肉眼不可见的。然而,皮肤细胞内的DNA也会在多年的太阳紫外线照射下积累损伤,这种损伤是可以测量的。
论文通讯作者、加州大学旧金山分校皮肤科助理教授A.Hunter Shain博士表示,这项研究中开发的检测皮肤损伤的基因组方法可用于估计普通人群中个体的基线黑色素瘤风险,并对皮肤科医生应该多久对某人进行一次癌症筛查提出建议。
Shain说,“事实证明,所谓正常的皮肤中的许多细胞充满了与黑色素瘤相关的突变,这些突变是阳光照射的结果。黑色素瘤通常仅在几十年的突变损伤积累后才会出现,但有些人的风险比其他人更大。有了我们开发的技术,那些积累突变最多的人可以被更密切地监测,并可以寻求更好地保护自己免受阳光照射。”
黑色素瘤产生于一种称为黑素细胞(melanocyte)的皮肤细胞中。黑素细胞制造黑色素,从而有助于保护包括大量存在的角质细胞在内的皮肤细胞免受阳光损伤。但是。当DNA损伤导致黑素细胞生长失控时,黑素细胞面临着最大的风险。
根据美国癌症协会的统计,黑色素瘤的发病率正在上升。2020年,美国约有10万人将被诊断为黑色素瘤,约有6850人死于这种癌症。白人一生患黑色素瘤的风险约为38分之1,黑人约为1000分之1,西班牙裔约为167分之1。黑色素瘤在早期发现时可以通过手术切除,但一旦扩散就很难治疗。
在这项研究中,这些作者一次一个细胞地对皮肤样本中的黑色细胞DNA进行测序,统计突变情况,重点是少数促进黑色素瘤出现和生长的突变。这些皮肤样本来自六个人:两个黑色素瘤幸存者和四个从未患过黑色素瘤的人的尸体。所有的人都是白人。这些作者分析了来自背部、头部、腿部、肩部、臀部和脚部的共133个黑素细胞的DNA。
这些作者发现,相比于从未患过黑色素瘤的人的皮肤中的黑素细胞,来自前癌症患者黑色素瘤附近的正常皮肤的黑素细胞有显著更多的突变,包括黑色素瘤相关的突变。
Shain说,有很多痣的人仍然应该接受筛查,但只有30%的黑色素瘤产生于已经存在的痣。
Shain说,“黑色素瘤真地可以凭空出现。我们在这项研究中发现,正常皮肤中含有很多已表现出一些癌症相关突变的黑素细胞。从本质上讲,我们发现了70%的黑色素瘤前体并不是由先前存在的痣产生的。”
Shain说,虽然更多的阳光照射会导致更高的风险,但这种相关性是复杂的,这还与肤色、固有的DNA修复能力和其他因素有关。儿童时期的晒伤可能比成年时期的职业暴露(如户外工作)带来更大的风险。Shain说,“测量突变可能是一种衡量所有这些变量对黑色素瘤风险的净影响的好方法。”
奇怪的是,与长期暴露在阳光下的区域(如面部)相比,黑色素瘤更经常发生在皮肤的间歇性暴露区域,如背部或大腿。与这一规律相一致的是,Shain的研究团队发现背部和四肢中的黑素细胞发生的突变比头颈部皮肤中的更多。
Shain说,这项研究中进行的单细胞分析使得人们能够关注皮肤中相对稀疏的黑素细胞,并识别出具有癌前突变的细胞,不过完成这一目标需要将新的技术方法组合在一起。
由于与包含众多细胞的典型生物样本相比,单个细胞中的DNA数量太少,因此必须对DNA进行扩增以获得足够的数量。用于扩增DNA的酶会引入错误,但Shain团队使用了额外的实验室方法来更好地区分扩增错误和真正的突变,并开发了计算机算法来进一步提高这种分析的准确性。
Shain说,“我们期待,这些方法的精简、自动化版本有朝一日将广泛用于测量黑色素瘤的风险,并可作为癌症筛查建议的基础。”
4. Cancer Immunol Res:识别出开发新型黑色素瘤疗法的新型潜在靶点
DOI:10.1158/2326-6066.CIR-19-0894

日前,一项刊登在国际杂志Cancer Immunology Research上的研究报告中,来自莫纳什大学等机构的科学家们通过研究在黑色素肿瘤表达发现了特殊的新型标志物—HLA相关的肽类,相关研究结果会有望帮助研究人员开发新型疫苗来抵御黑色素瘤的发生。
尽管当前科学家们在黑色素瘤疗法上取得了多项研究进展,但每隔5个小时仍然会有1名澳大利亚黑色素瘤患者因为没有得到有效的治疗而发生死亡,一种新型的疗法能通过识别在肿瘤细胞表面装饰的小型肿瘤特殊蛋白片段(肽类),来调节机体自身的免疫系统从而帮助检测并杀灭肿瘤细胞,文章中研究人员成功在黑色素瘤肿瘤表面识别了数千个特殊肽类,这些肽类能被宿主机体免疫系统所识别。
相关研究结果产生了快速的临床应用价值,目前研究人员正在联合研究利用一种拼接肽类对黑色素瘤患者进行临床接种试验;研究者Woods指出,黑色素瘤会在不同的生长状况下密切监视宿主机体的免疫系统,我们在这项研究中发现的多种黑色素瘤肽类是此前很多研究并未报道过的,这既让人惊讶又令人激动。研究结果表明,一些黑色素瘤肽类标志物能通过一种剪接过程来产生,在剪接过程中,蛋白质首先会被切割成为小片段肽类,随后两个片段会被粘贴在一起形成一种“拼接肽”(spliced peptide),通过识别具体的剪接肽类,其就能够在体外进行合成,随后输注到患者体内诱发免疫系统来识别并靶向作用特殊的肿瘤。
研究者的目的就是寻找开发新型黑色素瘤疗法的靶点,此前他们并不知道这些特殊拼接肽的存在、流行和重要性,也并不清楚其是否会被机体免疫系统所识别,如今研究人员发现了这些拼接肽,他们希望利用这些拼接肽作为诱饵来诱发宿主机体免疫系统发挥作用。研究者Andreas Behren指出,本文研究发现让我们非常兴奋,如今我们能够在不同免疫原性的患者体内识别特殊的黑色素瘤拼接肽分子了;基于此前研究结果,如今拼接肽抗原已经从原来免疫学研究中的好奇点转变成为一种全新的可操作靶点了,这不仅在黑色素瘤研究中如此,在其它癌症研究领域中也是如此;基于研究人员开发的新型工作流,如今他们就能识别出此前被忽略的多肽分子,这或许为后期免疫疗法和新型癌症疫苗的开发奠定了一定的基础,事实上,这种剪接过程的普遍性指向了一类特殊的抗原,其在感染性疾病、自身免疫性疾病和过敏性疾病的发生过程中都扮演着关键角色。
5. Cancer Cell:揭示干扰素γ引导黑色素瘤患者对癌症免疫疗法产生反应的分子机制
DOI:10.1016/j.ccell.2020.08.005

近日,一项刊登在国际杂志Cancer Cell上的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究揭示了干扰素γ(IFN-γ)引导恶性黑色素瘤患者疗法反应的分子机制,这些患者均采用了免疫检查点阻滞剂进行治疗,IFN-γ是一种能帮助激活宿主机体免疫细胞功能的免疫反应刺激信号分子。
研究者指出,帮助维持免疫系统功能的两种主要驱动子或能帮助有效攻击癌症,T细胞在肿瘤中浸润的水平源于免疫检查点阻滞剂的释放和下游相应干扰素γ的信号传导,阻断此前被认为能限制对癌细胞攻击作用的免疫检查点或能驱动干扰素γ的信号表达,从而就能放大机体的抗肿瘤免疫反应,进而诱发癌症免疫疗法所诱导的临床反应。
研究者Antoni Ribas说道,我们研究发现,当抵御癌症的预先免疫反应被放大时,免疫检查点阻滞疗法就能发挥作用,癌细胞能通过免疫检查点(CTLA-4和PD-1)来阻断免疫系统攻击癌细胞的方式,无论何时何时释放免疫检查点,免疫激活的增加都依赖于T细胞产生免疫激活细胞因子—干扰素γ的强度,其会导致超过600个基因被激活,进而放大机体的抗肿瘤免疫反应。如今,尽管科学家们在癌症免疫疗法研究上取得了巨大的成功,该疗法能利用宿主机体的免疫系统来更好地攻击癌细胞,但仅有一小部分患者会获益;于是研究人员就想继续通过研究来调查并利用基因组测序等技术更好地理解免疫检查点阻滞对癌症患者的作用效果以便能够克服局限性,并将疗法扩展到更多患者的治疗过程中去。
这项研究中,研究人员对接受抗PD-1抗体纳武单抗、纳武单抗和抗CTLA-4抗体易普利姆玛联合疗法的101名黑色素瘤患者进行研究,他们在DNA和RNA水平下分别对这些患者机体的黑色素瘤组织进行基因组测序来分析基线和治疗时的活组织特性,纳武单抗和易普利姆玛是两种癌症免疫疗法药物;在参与者治疗前和治疗中,研究者观察其机体肿瘤组织特性的改变来分析表现出临床反应和未表现出临床反应的患者机体中基因的表达情况,这或许就能让研究者观察到随着时间延续患者机体免疫反应发生改变的机制,同时还能重点分析当免疫系统处于活跃状态时癌细胞是如何启动基因进行表达的,随后研究者发现了干扰素γ基因,他们指出,通过开启或关闭一系列基因的表达来对干扰素γ产生反应的能力在绝大多数癌细胞中都能被保存下来。
最后研究者表示,后期他们还将继续深入研究来分析干扰素γ基因,并以此作为一种新方法来预测患者对免疫疗法所产生的反应,同时研究者还想寻找一种新型的组合性疗法来诱导干扰素信号的传导,并应用于更多癌症患者的治疗。
6. Advanced Therapeutics:新型纳米系统有效治疗黑色素瘤
DOI: 10.1002/adtp.202070017
在最近一项研究中,特拉维夫大学萨克勒医学院TAU生理学和药理学系的Ronit Satchi-Fainaro教授等人开发了一种创新的纳米技术给药系统,该系统显著提高了侵袭性皮肤癌黑色素瘤的治疗效果。

纳米载体是生物相容性和可生物降解的聚合物,其包含谷氨酸的重复单元。它把两种已被证实具有治疗黑色素瘤功效的不同家族的药物包装在一起:BRAF抑制剂(Dabrafenib)和MEK抑制剂(Selumetinib,已批准用于I型神经纤维瘤病患儿)。
该论文近日在《Advanced Therapeutics》杂志上发表。
Satchi-Fainaro教授说:“生物治疗的主要障碍之一是一段时间后癌细胞对药物产生了抗药性。我们认为,通过精确递送两种或多种靶向药物,可以从不同方向同时并有力地攻击癌细胞,我们可以延迟甚至阻止获得这种耐药性。”

“当今大多数肿瘤治疗都是以几种药物的混合物形式进行的。但是,即使药物是同时给药的,但由于基本参数的不同(例如它们在肿瘤中存活的时间长短),它们不能同时到达肿瘤。血流和每种药物到达肿瘤组织所花费的时间。因此,在大多数情况下,药物不能同时起作用,从而阻止了它们获得最佳的协同活性。”
为应对这些问题,研究人员开发了一种创新,高效且可生物降解的药物输送系统。选择了两种已知对黑色素瘤有效的药物:达布拉非尼和塞鲁米替尼,使用纳米载体将它们共同递送至肿瘤。选择用于该任务的药物纳米载体叫做PGA,一种谷氨酸的。该纳米载体是几年前在Satchi-Fainaro教授的实验室中开发,已经成功测试了在动物模型中治疗胰腺癌,乳腺癌和卵巢癌的能力。
研究人员首先根据毒性的水平和类型以及癌细胞对每种药物产生的耐药机制确定了两种药物之间的最佳比例。最终将确保最大的效力,最小的毒性和最佳的协同活性。关节给药的另一个重要优点是减少剂量:与每种药物相比,单独给药时所需的剂量要低得多。
下一步是使用化学修饰使聚合物载体与所选药物之间交联。该组合系统可以完全安全地在体内传播,不会对健康组织造成损害。到达癌细胞后,纳米载体会遇到组织蛋白酶酶家族的蛋白,该蛋白在恶性肿瘤中被高度激活。蛋白质降解聚合物,释放出变得活跃的药物并联合起来攻击肿瘤。
小鼠黑色素瘤模型上的测试结果表明其令人鼓舞的结果。纳米载体能够将两种药物递送至肿瘤,并同时将其释放到体内,到达肿瘤部位的有效剂量是分别递送药物的约20倍。另外,与对照组和用游离药物治疗的组相比,由纳米载体递送的药物实现的治疗效果持续时间长两倍至三倍。
根据研究人员的说法,新平台可以实现更低的剂量,约为常规药物鸡尾酒所需剂量的三分之一。总体而言,治疗也更安全,更有效。如有必要,新方法所允许的剂量要远远高于当前方法所允许的最大剂量,从而进一步提高治疗效果。
7. JID:研究揭示BRAF耐受性黑色素瘤恶化机制
DOI:doi.org/10.1016/j.jid.2020.08.012
BRAF-MEK抑制剂的靶向治疗是针对无法手术切除或扩散到身体其他部位的晚期黑色素瘤患者的有效治疗方法。但是,许多患者对该疗法产生抵抗力,这通常会导致进一步的转移。莫菲特癌症中心的研究人员帮助开发了这种联合疗法,目前正在努力更好地了解导致这种抗药性的原因,以期希望找到解决方法。
在《Journal of Investigative Dermatology》上发表的一篇新文章中,Moffitt研究人员确定了促红细胞生成素产生的肝细胞受体A2(EphA2)是黑色素瘤转移和BRAF-MEK抑制剂耐药的驱动因素。

EphA2是一种酪氨酸激酶受体,有助于在正常细胞中维持稳定的环境。但是,EphA2在许多癌症中通常过表达,并在其生长中起关键作用。它的确切功能取决于信号传导途径:经典的和非经典的。经典途径抑制癌细胞增殖并充当肿瘤抑制剂。非经典途径具有相反的作用,促进肿瘤存活和转移。
Moffitt团队与Sanford Burnham Prebys医学发现研究所的科学家合作,致力于EphA2的非经典途径。研究人员使用基于质谱的综合蛋白质组学技术,绘制了由非经典EphA2驱动的信号网络,发现该信号可增强癌细胞转移潜力。
该研究小组通过使用经非经典途径EphA2-S897E转导的黑色素瘤细胞建立小鼠模型,进一步证实了这一发现,并发现向肺部转移的数量明显更高。
Keiran Smalley博士说:“我们希望对导致BRAF和BRAF-MEK抑制剂治疗产生耐药性以及进一步转移的原因有了更好的了解,将使我们能够更好地了解治疗逃逸的过程,并为黑素瘤患者制定新的治疗策略。”
8. Clin Cancer Res:科学家识别出治疗黑色素瘤免疫疗法的新型潜在靶点
DOI:10.1158/1078-0432.CCR-19-3925
近日,一项刊登在国际杂志Clinical Cancer Research上的研究报告中,来自QIMR Berghofer医学研究所等机构的科学家们通过研究揭示了为何某些黑色素瘤患者对免疫疗法反应不佳,相关研究结果或能帮助研究者开发治疗潜在致死性癌症的新型靶向性疗法。
澳大利亚是全球黑色素瘤发病率最高的国家,澳大利亚健康和福利研究所估计,去年澳大利亚就有超过1.5万人被诊断为黑色素瘤,而且有1700多人死亡。这项研究中,研究者发现,人类黑色素瘤细胞中名为CD155的特殊蛋白或会让皮肤癌更难以利用免疫疗法进行治疗,研究者揭示了CD155对于转移性黑色素瘤患者进行免疫治疗有效性的重要性,而这在人类机体中此前并未发现过。

肿瘤似乎会利用CD155分子来躲避免疫T细胞的追捕,同时还能抵御免疫疗法的杀伤;CD155蛋白能在几乎所有癌细胞中进行表达,但在正常细胞中表达地较少,包括某些免疫细胞等,其是对于细胞间相互作用非常重要的粘连蛋白家族中的一部分。研究者Smyth表示,当前的免疫疗法能成功帮助解开免疫系统的束缚来杀灭黑色素瘤细胞,但在某些患者体内,肿瘤细胞仍然会隐藏起来使得疗法无效,最终引发患者死亡。黑色素瘤细胞中高水平的CD155似乎能帮助肿瘤躲避T细胞的检测,并能欺骗T细胞不去触碰肿瘤,在相互作用期间,肿瘤的CD155似乎会损伤T细胞,降低其识别并杀灭肿瘤细胞的能力,而减少转移性黑色素瘤患者机体中的肿瘤CD155的水平则能作为一种新方法来改善免疫疗法的治疗效率,并能挽救更多患者的生命。
文章中,研究人员利用新型成像技术分析了收集自患者机体的疗法前肿瘤样本,随后他们将肿瘤CD155的水平与患者的预后联系起来,研究者表示,成像结果显示黑色素瘤中存在高水平的CD155,而且携带高水平CD155的患者往往健康状况较差,而且对免疫疗法并没有反应;因此,CD155的水平或会使得癌细胞出现免疫逃避现象,而T细胞无法杀灭肿瘤是因为CD155蛋白会使得T细胞失衡,并在其发挥作用前关闭其功能;目前并没有针对黑色素瘤的治疗性手段能靶向作用CD155,因此研究者就希望深入研究开发出新型免疫疗法来靶向作用CD155蛋白,从而抑制肿瘤的发展。
本文研究基于研究者2018年的一项研究,该研究表明,肿瘤和免疫细胞中的CD155对于肿瘤的生长和扩散至关重要,后期研究者希望能通过更为深入的研究来分析是否CD155在其它癌症对免疫疗法的反应过程中扮演着关键角色。
9. Nat Cancer:为何男性在遗传上更易患黑色素瘤?
doi:10.1038/s43018-020-0077-8
随着今年夏季对COVID-19疫情限制的放宽,将会有越来越多的加拿大人有时间呆在户外充分享受阳光给其带来的欢悦;近日,一项刊登在国际杂志Nature Cancer上的研究报告中,来自麦吉尔大学等机构的科学家们通过研究揭示了为何男性更易在遗传上患上皮肤癌。文章中,研究人员在X染色体上识别出了三个携带明显突变的基因,女性拥有两个X染色体,而男性则拥有一个X染色体和一个Y染色体,研究人员在X染色体上所发现的三个明显突变的基因中,仅有一个基因拥有仅在男性机体中存在的特殊突变类型。

女性则会在其它问题基因上发育出其它类型的突变,但由于其拥有两个X染色体(男性仅有一个X染色体),因此其就拥有基因的两个拷贝,当其中一个拷贝发生突变时,另一个拷贝还能作为备份,这些突变或许就能帮助研究人员解释为何男性黑色素瘤患者的癌症发病率更高,而且存活率也更低。
引发黑色素瘤最重要的风险因素之一就是来自太阳和室内美黑的紫外线,通过解释紫外线暴露所引发的特殊遗传突变,科学家们在基因测序技术上的进步就能帮助其深度解析黑色素瘤性别差异背后的原因,这项研究中,研究人员分析了超过一千多例黑色素瘤患者病例,解释了人类在患黑色素瘤风险上的性别差异,后期研究人员将会继续深入研究,其中包括确定这些突变如何影响黑色素瘤的生物学特性以及患者如何对免疫疗法产生反应。
研究者Watson教授说道,免疫疗法给很多黑色素瘤患者的治疗带来了革命性的变革,其能重新激活患者体内的免疫系统来帮助清除机体内的癌细胞;然而不幸的是,大量的患者并不会对该疗法产生反应,因此研究人员就需要联合深入研究理解背后的分子机理,从而开发出有效的抗癌策略。
除了性别差异在黑色素瘤不同发病率和患者存活率上扮演的关键角色外,如今越来越多的数据也表明,不同性别的个体或许对最新的疗法也会产生不同的反应;目前研究人员正在调查他们所揭示的基因突变中的性别差异是否能够帮助解释上述原因,加深研究人员对多种黑色素瘤亚型遗产特性的了解,或能帮助研究人员开发出新型个体化抗癌疗法,从而让患者与疗法相匹配来更加有效地对患者进行治疗。
10. Allergy:抗组胺药物可用于治疗恶性黑色素瘤
DOI: 10.1111/all.14273
一种非常常见的过敏药能否改善患有严重皮肤癌,恶性黑色素瘤的患者的生存率?瑞典隆德大学的一项发表在《Allergy》杂志上的新研究表明可能确实如此。
文章作者霍坎·奥尔森教授强调:“以前的研究表明,抗组胺药对于乳腺癌患者的生存而言具有益处。如今在恶性黑色素瘤患者中也有同样的发现。但是,需要更多的研究来证实结果。”
在这项研究中,研究人员分析了被诊断为恶性黑色素瘤患者中使用六种抗组胺药:氯雷他定,西替利嗪,氯雷他定,clemastine,依巴斯汀和非索非那定的情况及其治疗效果。

作者收集了来自于三个大型机构,总计24562人的信息。在这些人中,有1,253位是抗组胺药使用者。最常用的地氯雷他定(395)西替利嗪(324),氯雷他定(251)或clemastine(192)。其他抗组胺药的使用人数则少得多。
“与未使用抗组胺药的人进行比较时,我们观察到了使用去氯雷他定的人存活率有所提高,尤其是在65岁及65岁以上的人群中。其他抗组胺药的使用没有明显的生存效果。 ,此外,去氯雷他定和氯雷他定的使用似乎也减少了患新的恶性黑色素瘤的风险,”作者说道。
“这一发现对于将来的抗黑色素瘤药物的开发可能具有一定的借鉴意义。此外,这些药物几乎没有副作用。”
该研究小组现正计划进行动物实验以了解其背后的机制,适当的剂量和最佳治疗期。
“我们正在与巴塞罗那和斯德哥尔摩的研究人员合作。在隆德,我们正在进行动物和人类受试者的研究,其中将评估抗组胺药的治疗效果,” 奥尔森教授总结道。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


