2020年7月CRISPR/Cas研究进展
来源:本站原创 2020-07-30 21:15
2020年7月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。 图片来自Thoma
2020年7月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的7月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Nat Biotechnol:新型DNA碱基编辑器扩大精准基因组编辑的应用领域
doi:10.1038/s41587-020-0609-x
在一项新的研究中,来自美国麻省总医院和哈佛医学院的研究人员开发出的新型基因组编辑技术有潜力有助于理解基于C→G(由胞嘧啶突变为鸟嘌呤)单碱基变化的疾病相关基因突变。这些新的碱基编辑器也可最大限度地减少可能导致不良副作用的非预期(“脱靶”)突变。相关研究结果于2020年7月20日在线发表在Nature Biotechnology期刊上,论文标题为“CRISPR C-to-G base editors for inducing targeted DNA transversions in human cells”。论文通讯作者为麻省总医院的Julian Grünewald博士和 J. Keith Joung博士。论文第一作者为麻省总医院的Ibrahim C. Kurt和Ronghao Zhou。

这些由CRISPR引导的新型DNA碱基编辑技术旨在高效地诱导DNA碱基的颠换(transversion,即一个嘌呤碱基被另一个嘧啶碱基替换,或者一个嘧啶碱基被另一个嘌呤碱基置换),同时将不需要的“旁观者”突变水平降至最低。在这篇论文中,这些作者描述了一种概念验证的称为CGBE1的C→G碱基编辑器,以及它的一个较小版本:miniCGBE1。
2.Science子刊:新型碱基编辑器A3G-BE可将基因编辑准确度提高高达6000倍
doi:10.1126/sciadv.aba1773
在一项新的研究中,来自中国科学院大学、中国农业科学院和美国莱斯大学的研究人员发现一种可以大幅提升基因编辑准确性的技术。与目前被认为是最先进的碱基编辑器BE4max相比,他们推出的基因编辑工具可在疾病序列模型中将基于CRISPR的编辑准确度提高高达6000倍。相关研究结果发表在2020年7月15日的Science Advances期刊上,论文标题为“Single C-to-T substitution using engineered APOBEC3G-nCas9 base editors with minimum genome- and transcriptome-wide off-target effects”。论文通讯作者为中国农业科学院农业基因组研究所的左二伟(Erwei Zuo)博士和莱斯大学生物分子工程师Xue Sherry Gao博士。
这些研究人员试图通过一系列的蛋白工程实验来开发一种新型的碱基编辑器。这种新的胞嘧啶碱基编辑器称为A3G-BE,通过仅编辑连续碱基C中的第二个C,大大提高了编辑精度。
3.Science:发现一种可靠的CRISPR/Cas13a系统抑制剂
doi:10.1126/science.abb6151; doi:10.1126/science.abc8243
在VI型CRISPR-Cas抗病毒反应过程中,CRISPR RNA(crRNA)引导的Cas13核酸酶不加选择地破坏细菌细胞及其入侵者的RNA,同时阻止受感染宿主的生长和病毒的传播,从而保护细菌群体免受病毒感染。这种反应是由Cas13核酸酶介导的,它在识别到与其向导RNA(gRNA)互补的病毒转录物后,进行大量的RNA降解。然而,病毒如何对抗这种细菌免疫系统还不清楚。
在一项新的研究中,来自美国洛克菲勒大学、纪念斯隆凯特琳癌症中心和康奈尔大学的研究人员发现作为一种由噬菌体编码的抑制剂,AcrVIA1能与Cas13a结合,从而封堵gRNA和阻止这种核酸酶激活。这表明AcrVIA1可潜在地作为Cas13a核酸酶的控制开关。相关研究结果发表在2020年7月3日的Science期刊上,论文标题为“A phage-encoded anti-CRISPR enables complete evasion of type VI-A CRISPR-Cas immunity”。
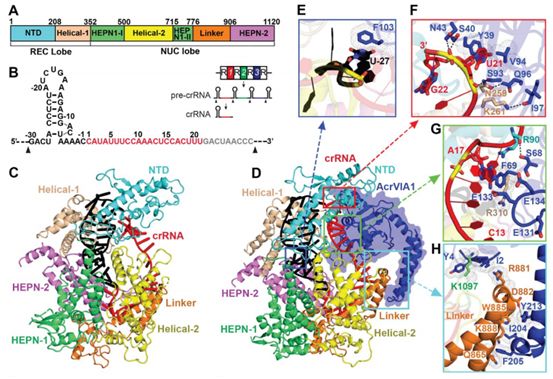
他们发现作为一种编码抗CRISPR蛋白,AcrVIA1由李斯特菌噬菌体(ϕLS46)编码,它能够让斯氏李斯特菌(Listeria seeligeri)的VI-A型CRISPR系统失活。利用遗传学、生物化学和结构生物学,他们发现AcrVIA1与Cas13a核酸酶的向导暴露面相互作用,阻止了靶RNA的进入和这种核酸酶激活所需的构象变化。
4.Nat Biotechnol:开发出可预测基因组编辑器脱靶活性的工具---CHANGE-seq
doi:10.1038/s41587-020-0555-7
在一项新的研究中,来自美国圣犹大儿童研究医院、卡内基梅隆大学和美国国家标准技术局等研究机构的研究人员开发出一种易于使用的灵敏的高通量的方法,用于确定由CRISPR-Cas9等基因组编辑器引起的非预期的DNA双链断裂的位置。他们将这种方法称为CHANGE-seq(Circularization for High-throughput Analysis of Nuclease Genome-wide Effects by Sequencing)。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“CHANGE-seq reveals genetic and epigenetic effects on CRISPR–Cas9 genome-wide activity”。
论文通讯作者、圣犹大儿童研究医院的Shengdar Tsai博士说,“CHANGE-seq是第一个真正可扩展的用于阐明CRISPR-Cas核酸酶的非预期活性的方法。有了这种方法,科学家们如今可以快速挑选出最好的、最安全的基因组编辑和靶点,用于治疗性编辑,比如用于治疗镰状细胞疾病和用于癌症免疫疗法。”
5.Nat Biotechnol:中科院高彩霞团队开发出针对植物的新型可预测的多核苷酸缺失系统
doi:10.1038/s41587-020-0566-4
CRISPR-Cas9系统已在基因组工程中得到广泛应用。在这种系统中,sgRNA引导的Cas9核酸酶产生染色体双链断裂(DSB),DSB主要通过非同源末端连接(nonhomologous end joining, NHEJ)进行修复,从而导致频繁的长1~3 bp的短插入和缺失(indel)产生。然而,这些小 indel的异质性使得破坏这些调节性 DNA 在技术上具有挑战性。因此,开发一种精确的、可预测的多核苷酸缺失系统对这些调节性DNA的基因功能分析和应用具有重要意义。
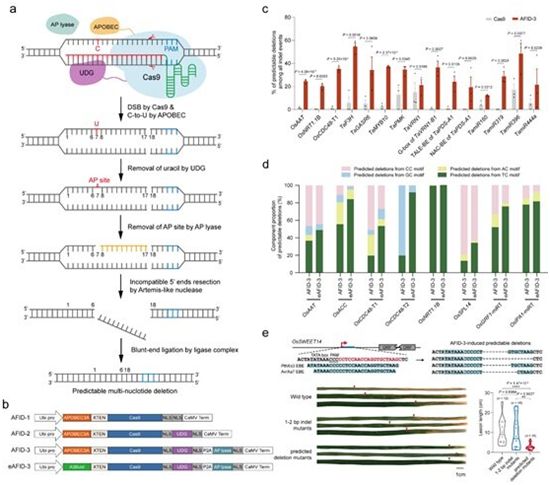
中国科学院遗传与发育生物学研究所的高彩霞(Gao Caixia)教授及其研究团队一直致力于开发新技术,以实现高效、特异的基因组工程。在一项新的研究中,这些研究人员基于胞嘧啶脱氨和碱基切除修复(base excision repair, BER)机制,开发出一系列APOBEC-Cas9融合诱导缺失系统(APOBEC-Cas9 fusion-induced deletion system, AFID),将Cas9与人APOBEC3A(A3A)、尿嘧啶DNA-葡糖苷酶(UDG)和AP裂解酶结合,成功在水稻和小麦基因组中诱导出新型的精准、可预测的多核苷酸缺失。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“Precise, predictable multi-nucleotide deletions in rice and wheat using APOBEC–Cas9”。
6.Nat Metab: 新研究有助于治疗I型糖尿病
doi:10.1038/s42255-020-0254-1
当人自身的免疫系统破坏胰腺中产生胰岛素的β细胞时,就会导致1型糖尿病的发生。近年来,科学家们已经学会了如何生长大量的替代β细胞,但研究人员仍在尝试许多方法来保护这些细胞免受免疫攻击。近日,Joslin糖尿病中心的研究人员现在发现了一种新的方法,最终可能有助于保护这种移植的β细胞或减缓疾病的发作。对小鼠模型和人体细胞的研究表明,靶向一种叫做“肾酶(renalase)”的蛋白质可以通过增强β细胞抵抗力来保护自身抵抗免疫系统攻击。相关结果发表在最近的《Nature Metabolism》杂志上。
首先,作者使用一种基于CRISPR基因编辑方法的筛选技术,并使用来自“非肥胖糖尿病”(NOD)小鼠的β细胞系用于模拟1型糖尿病。 “基因组CRISPR筛选是发现新靶标的有力工具,我们希望它能帮助我们找到保护β细胞的任何突变,”共同作者 Yi说。通过对存活的β细胞进行CRISPR筛选,作者得到了十几个感兴趣的基因。最引人注目的是肾酶基因,以前的研究表明它与1型糖尿病有关。
接下来,研究人员创建了NOD小鼠β细胞,其中一些 “敲除”了肾酶基因。他们将这些细胞移植到患有自身免疫性糖尿病的NOD小鼠身上。结果表明,野生型β细胞移植后最终死亡,但肾酶基因敲除的细胞最终存活下来。
7.Science新发现!巨大噬菌体或拥有一种能进行理想基因编辑操作的迷你Cas蛋白—CasΦ蛋白!
doi:10.1126/science.abb1400
近日,一篇刊登在国际杂志Science上题为“CRISPR-CasΦ from huge phages is a hypercompact genome editor”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,巨大噬菌体(megaphages)或许拥有进行理想基因编辑的mini-Cas蛋白。
CRISPR-Cas9和其相关的基因编辑工具的核心DNA切割蛋白最初来自于细菌,但最新发现的多种Cas蛋白显然是在感染细菌的病毒中进化而来的;新的Cas蛋白是在已知最大的感染细菌的病毒(噬菌体)中发现的,同时其也是迄今为止发现的最紧凑的工作Cas突变体,其只有Cas9蛋白尺寸的一半左右。更小、更为紧凑的Cas蛋白往往更容易被运送到细胞中进行基因编辑,因为其能被装入较小的运输载体中,目前最流行的一种运输载体就是腺相关病毒(AAV),超级紧凑的Cas蛋白也能在AAV内部为其它额外的“货物”留出空间,作为目前已知的最小的Cas蛋白,研究者新发现的CasΦ(Cas-phi)在被运输到细胞中来操纵作物基因或治疗人类疾病时,其要比当前的基因编辑工具更加具有优势。
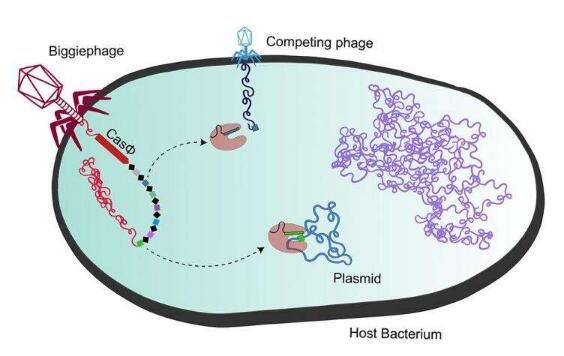
研究者Patrick Pausch说道,腺病毒是运输基因载体完美的特洛伊木马,其能非常容易地对病毒进行编程并使其到达身体几乎任何部位,但你智能将一个很小的Cas9装入这样的病毒中来对其进行运输,如果有另外一种相比Cas9而言更为紧凑的CRISPR-Cas系统,那么就有足够的空间来容纳其它额外的元件,不同的蛋白质就会融合到Cas蛋白、DNA修复模板或其它能调节Cas蛋白并控制基因编辑结果的因子中。很显然,这些巨大噬菌体能利用CasΦ蛋白来诱骗细菌去抵御病毒,而不是自己。
8.PLoS Biol:科学家有望开发出脱靶率更低的安全CRISPR基因编辑技术
doi:10.1371/journal.pbio.3000747
CRISPR系统是一种能够靶向编辑基因组的强大工具,其具有明显的治疗潜力,然而其经常也会不恰当地编辑一些“脱靶”(off-target)位点,近日,一项刊登在国际杂志PLoS Biology上的研究报告中,来自温州医科大学等机构的科学家们通过研究表示,突变CRISPR基因编辑系统核心的酶类或许就能改善其编辑的精准度,相关研究结果或能为基因编辑提供一种相比使用未修饰酶类系统更安全的治疗性策略。
为了深入研究来自金黄色葡萄球菌的Cas9是否能被修饰以高保真性来切割预期的靶点,研究人员开发了一系列新型的Cas9突变体,同时在维持预期位点较高活性的同时检测其区分不完美配对的能力,他们发现了一种突变体,其都能区分并拒绝gRNA和DNA之间的单碱基对错误匹配,无论靶点如何,这都能使保真度相比原始酶类提高了93倍;研究者表示,这种突变影响了部分的识别结构域,即酶类的特殊区域,该区域能协调酶类和gRNA-DNA复合体之间的接触,这种突变可能会削弱这些接触,从而就能确保只有来自完美序列匹配的最强配对才能够触发酶类活性。
9.Nature重大进展!开发高效的线粒体DNA碱基编辑器!
doi:10.1038/s41586-020-2477-4
在一项近日发表在Nature上的突破性研究(A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing)中,研究人员将利剑打成犁,将一种细菌毒素转化为一种基因组编辑工具,这是第一次可以对细胞的"发电厂"线粒体中的DNA进行精确的改变。该工具在人体细胞的实验室实验中发挥了作用,它可能开启一扇新的研究之门--以及未来数十种难以治疗的由线粒体DNA (mtDNA)突变引起的疾病的新疗法。这些罕见的疾病,包括Leber遗传性视神经病变和致命的婴儿心肌病,总发病率约为1 / 4000。到目前为止,对这些疾病的研究一直受到阻碍,部分原因是没有办法在小鼠品系中复制这种突变。
这项新研究中开发的这一新工具结合了CRISPR的特点和一种叫做转录激活子样效应子(TALEs)的老技术,三个团队合力创建了这个新工具。"让这个项目如此有趣并最终成功的原因是三个实验室有机地聚在一起,而正是科学让我们聚在一起。"Broad研究所研究员、该研究通讯作者David Liu说道。
10.Nat Methods:开发出CRISPR辅助的新技术来检测活细胞中的RNA结合蛋白 未来有望助力人类疾病研究
doi:10.1038/s41592-020-0866-0
尽管目前科学家们还并未完全理解RNA分子的多样性,但他们认为,与这些RNA分子结合的RNA结合蛋白或与多种机体疾病的发生直接相关,近日,一项刊登在国际杂志Nature Methods上题为“CRISPR-assisted detection of RNA–protein interactions in living cells”的研究报告中,来自香港城市大学等机构的科学家们开发了一种名为CARPID的新型检测方法,其能识别活细胞中特殊RNAs的结合蛋白,这种新方法或能应用到多重类型的细胞研究领域,比如从识别癌症生物标志物到检测治疗多种病毒性疾病的潜在药物靶点等。
分子生物学的中心法则是DNA转录成为RNA,以及RNA最终翻译成为蛋白质,但实际上,只有大约2%的RNAs能够编码蛋白,而其余98%被称之为非编码RNAs(ncRNA)的RNA分子则由于其具有神秘的功能而被视为“暗物质”。近些年来,科学家们开始努力研究旨在揭开RNA的真实功能,尤其是长链非编码RNAs(lncRNA,长度仅有200多个核苷酸),lncRNA广泛被接受为能参与调节基因表达的重要细胞组分,同时其也是研究人员最感兴趣研究的RNA的一种。
11.Curr Gene Ther:基于ADAR的人工RNA编辑有望用于基因治疗
doi:10.2174/1566523220666200516170137
许多由点突变引起的疾病都没有现成的治疗方法。日本北陆先端科学技术大学院大学的Toshifumi Tsukahara教授及其同事们正在研究一种利用人工RNA编辑的治疗方法。人工定点RNA编辑是一种修改基因并最终调控蛋白功能的重要技术。Tsukahara团队正在尝试通过人工RNA编辑来修改转录物(RNA)的遗传密码,以治疗遗传性疾病。
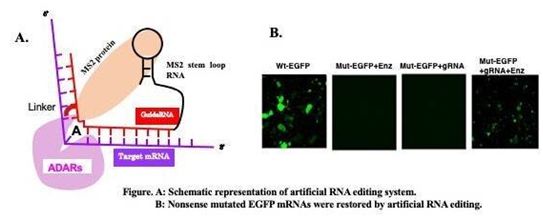
RNA编辑是一个生理过程,广泛存在于生物体内,可从单个基因中产生各种不同功能的蛋白。在哺乳动物中,RNA链中的碱基C或A可经碱基序列特异性水解后脱氨,从而使得C被U取代,A被I(肌苷)取代。鉴于I与C形成沃森-克里克(Watson-Crick)碱基对,因此在遗传密码上,I与G同义。这些碱基转换是由于A或C的脱氨而发生的,已经发现这是由ADAR和APOBEC家族酶催化的。最近,已经报道了各种利用ADAR进行人工RNA编辑的RNA修复技术。
在一篇近期发表在Current Gene Therapy期刊上的论文中,Tsukahara团队综述了应用ADAR恢复遗传密码的最新研究成果,以及在利用ADAR进行人工RNA编辑过程中涉及的不同方法。他们还谈到了ADAR各种异构体的比较研究。因此,他们将尝试对人工RNA编辑和ADAR的作用进行详细的概述,重点是酶促定点A→I编辑。
大多数的人工RNA编辑系统都是利用催化酶ADAR的活性位点和与靶标互补的向导RNA(gRNA)来招募活性位点到靶标RNA上。一种人工RNA编辑方法是使用化学方法。Vogel及其同事们采用SNAP标签将ADAR与gRNA连接起来,并报道该系统在体外和体内都是有效的。然而,这种技术需要持续供应效应物分子才能有效。据悉,它还可以利用RNA结合蛋白将gRNA与酶结合。两种源于噬菌体的拴系系统通常用于真核生物:Lambda N系统和MS2系统。利用ADAR酶与MS2系统可以实现遗传密码的恢复,在基因治疗方面具有前景。(生物谷 Bioon.com)

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的7月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Nat Biotechnol:新型DNA碱基编辑器扩大精准基因组编辑的应用领域
doi:10.1038/s41587-020-0609-x
在一项新的研究中,来自美国麻省总医院和哈佛医学院的研究人员开发出的新型基因组编辑技术有潜力有助于理解基于C→G(由胞嘧啶突变为鸟嘌呤)单碱基变化的疾病相关基因突变。这些新的碱基编辑器也可最大限度地减少可能导致不良副作用的非预期(“脱靶”)突变。相关研究结果于2020年7月20日在线发表在Nature Biotechnology期刊上,论文标题为“CRISPR C-to-G base editors for inducing targeted DNA transversions in human cells”。论文通讯作者为麻省总医院的Julian Grünewald博士和 J. Keith Joung博士。论文第一作者为麻省总医院的Ibrahim C. Kurt和Ronghao Zhou。

图片来自CC0 Public Domain。
这些由CRISPR引导的新型DNA碱基编辑技术旨在高效地诱导DNA碱基的颠换(transversion,即一个嘌呤碱基被另一个嘧啶碱基替换,或者一个嘧啶碱基被另一个嘌呤碱基置换),同时将不需要的“旁观者”突变水平降至最低。在这篇论文中,这些作者描述了一种概念验证的称为CGBE1的C→G碱基编辑器,以及它的一个较小版本:miniCGBE1。
2.Science子刊:新型碱基编辑器A3G-BE可将基因编辑准确度提高高达6000倍
doi:10.1126/sciadv.aba1773
在一项新的研究中,来自中国科学院大学、中国农业科学院和美国莱斯大学的研究人员发现一种可以大幅提升基因编辑准确性的技术。与目前被认为是最先进的碱基编辑器BE4max相比,他们推出的基因编辑工具可在疾病序列模型中将基于CRISPR的编辑准确度提高高达6000倍。相关研究结果发表在2020年7月15日的Science Advances期刊上,论文标题为“Single C-to-T substitution using engineered APOBEC3G-nCas9 base editors with minimum genome- and transcriptome-wide off-target effects”。论文通讯作者为中国农业科学院农业基因组研究所的左二伟(Erwei Zuo)博士和莱斯大学生物分子工程师Xue Sherry Gao博士。
这些研究人员试图通过一系列的蛋白工程实验来开发一种新型的碱基编辑器。这种新的胞嘧啶碱基编辑器称为A3G-BE,通过仅编辑连续碱基C中的第二个C,大大提高了编辑精度。
3.Science:发现一种可靠的CRISPR/Cas13a系统抑制剂
doi:10.1126/science.abb6151; doi:10.1126/science.abc8243
在VI型CRISPR-Cas抗病毒反应过程中,CRISPR RNA(crRNA)引导的Cas13核酸酶不加选择地破坏细菌细胞及其入侵者的RNA,同时阻止受感染宿主的生长和病毒的传播,从而保护细菌群体免受病毒感染。这种反应是由Cas13核酸酶介导的,它在识别到与其向导RNA(gRNA)互补的病毒转录物后,进行大量的RNA降解。然而,病毒如何对抗这种细菌免疫系统还不清楚。
在一项新的研究中,来自美国洛克菲勒大学、纪念斯隆凯特琳癌症中心和康奈尔大学的研究人员发现作为一种由噬菌体编码的抑制剂,AcrVIA1能与Cas13a结合,从而封堵gRNA和阻止这种核酸酶激活。这表明AcrVIA1可潜在地作为Cas13a核酸酶的控制开关。相关研究结果发表在2020年7月3日的Science期刊上,论文标题为“A phage-encoded anti-CRISPR enables complete evasion of type VI-A CRISPR-Cas immunity”。

图片来自Science, 2020, doi:10.1126/science.abb6151。
他们发现作为一种编码抗CRISPR蛋白,AcrVIA1由李斯特菌噬菌体(ϕLS46)编码,它能够让斯氏李斯特菌(Listeria seeligeri)的VI-A型CRISPR系统失活。利用遗传学、生物化学和结构生物学,他们发现AcrVIA1与Cas13a核酸酶的向导暴露面相互作用,阻止了靶RNA的进入和这种核酸酶激活所需的构象变化。
4.Nat Biotechnol:开发出可预测基因组编辑器脱靶活性的工具---CHANGE-seq
doi:10.1038/s41587-020-0555-7
在一项新的研究中,来自美国圣犹大儿童研究医院、卡内基梅隆大学和美国国家标准技术局等研究机构的研究人员开发出一种易于使用的灵敏的高通量的方法,用于确定由CRISPR-Cas9等基因组编辑器引起的非预期的DNA双链断裂的位置。他们将这种方法称为CHANGE-seq(Circularization for High-throughput Analysis of Nuclease Genome-wide Effects by Sequencing)。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“CHANGE-seq reveals genetic and epigenetic effects on CRISPR–Cas9 genome-wide activity”。
论文通讯作者、圣犹大儿童研究医院的Shengdar Tsai博士说,“CHANGE-seq是第一个真正可扩展的用于阐明CRISPR-Cas核酸酶的非预期活性的方法。有了这种方法,科学家们如今可以快速挑选出最好的、最安全的基因组编辑和靶点,用于治疗性编辑,比如用于治疗镰状细胞疾病和用于癌症免疫疗法。”
5.Nat Biotechnol:中科院高彩霞团队开发出针对植物的新型可预测的多核苷酸缺失系统
doi:10.1038/s41587-020-0566-4
CRISPR-Cas9系统已在基因组工程中得到广泛应用。在这种系统中,sgRNA引导的Cas9核酸酶产生染色体双链断裂(DSB),DSB主要通过非同源末端连接(nonhomologous end joining, NHEJ)进行修复,从而导致频繁的长1~3 bp的短插入和缺失(indel)产生。然而,这些小 indel的异质性使得破坏这些调节性 DNA 在技术上具有挑战性。因此,开发一种精确的、可预测的多核苷酸缺失系统对这些调节性DNA的基因功能分析和应用具有重要意义。

图片来自Nature Biotechnology, 2020, doi:10.1038/s41587-020-0566-4。
中国科学院遗传与发育生物学研究所的高彩霞(Gao Caixia)教授及其研究团队一直致力于开发新技术,以实现高效、特异的基因组工程。在一项新的研究中,这些研究人员基于胞嘧啶脱氨和碱基切除修复(base excision repair, BER)机制,开发出一系列APOBEC-Cas9融合诱导缺失系统(APOBEC-Cas9 fusion-induced deletion system, AFID),将Cas9与人APOBEC3A(A3A)、尿嘧啶DNA-葡糖苷酶(UDG)和AP裂解酶结合,成功在水稻和小麦基因组中诱导出新型的精准、可预测的多核苷酸缺失。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“Precise, predictable multi-nucleotide deletions in rice and wheat using APOBEC–Cas9”。
6.Nat Metab: 新研究有助于治疗I型糖尿病
doi:10.1038/s42255-020-0254-1
当人自身的免疫系统破坏胰腺中产生胰岛素的β细胞时,就会导致1型糖尿病的发生。近年来,科学家们已经学会了如何生长大量的替代β细胞,但研究人员仍在尝试许多方法来保护这些细胞免受免疫攻击。近日,Joslin糖尿病中心的研究人员现在发现了一种新的方法,最终可能有助于保护这种移植的β细胞或减缓疾病的发作。对小鼠模型和人体细胞的研究表明,靶向一种叫做“肾酶(renalase)”的蛋白质可以通过增强β细胞抵抗力来保护自身抵抗免疫系统攻击。相关结果发表在最近的《Nature Metabolism》杂志上。
首先,作者使用一种基于CRISPR基因编辑方法的筛选技术,并使用来自“非肥胖糖尿病”(NOD)小鼠的β细胞系用于模拟1型糖尿病。 “基因组CRISPR筛选是发现新靶标的有力工具,我们希望它能帮助我们找到保护β细胞的任何突变,”共同作者 Yi说。通过对存活的β细胞进行CRISPR筛选,作者得到了十几个感兴趣的基因。最引人注目的是肾酶基因,以前的研究表明它与1型糖尿病有关。
接下来,研究人员创建了NOD小鼠β细胞,其中一些 “敲除”了肾酶基因。他们将这些细胞移植到患有自身免疫性糖尿病的NOD小鼠身上。结果表明,野生型β细胞移植后最终死亡,但肾酶基因敲除的细胞最终存活下来。
7.Science新发现!巨大噬菌体或拥有一种能进行理想基因编辑操作的迷你Cas蛋白—CasΦ蛋白!
doi:10.1126/science.abb1400
近日,一篇刊登在国际杂志Science上题为“CRISPR-CasΦ from huge phages is a hypercompact genome editor”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,巨大噬菌体(megaphages)或许拥有进行理想基因编辑的mini-Cas蛋白。
CRISPR-Cas9和其相关的基因编辑工具的核心DNA切割蛋白最初来自于细菌,但最新发现的多种Cas蛋白显然是在感染细菌的病毒中进化而来的;新的Cas蛋白是在已知最大的感染细菌的病毒(噬菌体)中发现的,同时其也是迄今为止发现的最紧凑的工作Cas突变体,其只有Cas9蛋白尺寸的一半左右。更小、更为紧凑的Cas蛋白往往更容易被运送到细胞中进行基因编辑,因为其能被装入较小的运输载体中,目前最流行的一种运输载体就是腺相关病毒(AAV),超级紧凑的Cas蛋白也能在AAV内部为其它额外的“货物”留出空间,作为目前已知的最小的Cas蛋白,研究者新发现的CasΦ(Cas-phi)在被运输到细胞中来操纵作物基因或治疗人类疾病时,其要比当前的基因编辑工具更加具有优势。

图片来源:Basem Al-Shayeb and Patrick Pausch, UC Berkeley。
研究者Patrick Pausch说道,腺病毒是运输基因载体完美的特洛伊木马,其能非常容易地对病毒进行编程并使其到达身体几乎任何部位,但你智能将一个很小的Cas9装入这样的病毒中来对其进行运输,如果有另外一种相比Cas9而言更为紧凑的CRISPR-Cas系统,那么就有足够的空间来容纳其它额外的元件,不同的蛋白质就会融合到Cas蛋白、DNA修复模板或其它能调节Cas蛋白并控制基因编辑结果的因子中。很显然,这些巨大噬菌体能利用CasΦ蛋白来诱骗细菌去抵御病毒,而不是自己。
8.PLoS Biol:科学家有望开发出脱靶率更低的安全CRISPR基因编辑技术
doi:10.1371/journal.pbio.3000747
CRISPR系统是一种能够靶向编辑基因组的强大工具,其具有明显的治疗潜力,然而其经常也会不恰当地编辑一些“脱靶”(off-target)位点,近日,一项刊登在国际杂志PLoS Biology上的研究报告中,来自温州医科大学等机构的科学家们通过研究表示,突变CRISPR基因编辑系统核心的酶类或许就能改善其编辑的精准度,相关研究结果或能为基因编辑提供一种相比使用未修饰酶类系统更安全的治疗性策略。
为了深入研究来自金黄色葡萄球菌的Cas9是否能被修饰以高保真性来切割预期的靶点,研究人员开发了一系列新型的Cas9突变体,同时在维持预期位点较高活性的同时检测其区分不完美配对的能力,他们发现了一种突变体,其都能区分并拒绝gRNA和DNA之间的单碱基对错误匹配,无论靶点如何,这都能使保真度相比原始酶类提高了93倍;研究者表示,这种突变影响了部分的识别结构域,即酶类的特殊区域,该区域能协调酶类和gRNA-DNA复合体之间的接触,这种突变可能会削弱这些接触,从而就能确保只有来自完美序列匹配的最强配对才能够触发酶类活性。
9.Nature重大进展!开发高效的线粒体DNA碱基编辑器!
doi:10.1038/s41586-020-2477-4
在一项近日发表在Nature上的突破性研究(A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing)中,研究人员将利剑打成犁,将一种细菌毒素转化为一种基因组编辑工具,这是第一次可以对细胞的"发电厂"线粒体中的DNA进行精确的改变。该工具在人体细胞的实验室实验中发挥了作用,它可能开启一扇新的研究之门--以及未来数十种难以治疗的由线粒体DNA (mtDNA)突变引起的疾病的新疗法。这些罕见的疾病,包括Leber遗传性视神经病变和致命的婴儿心肌病,总发病率约为1 / 4000。到目前为止,对这些疾病的研究一直受到阻碍,部分原因是没有办法在小鼠品系中复制这种突变。
这项新研究中开发的这一新工具结合了CRISPR的特点和一种叫做转录激活子样效应子(TALEs)的老技术,三个团队合力创建了这个新工具。"让这个项目如此有趣并最终成功的原因是三个实验室有机地聚在一起,而正是科学让我们聚在一起。"Broad研究所研究员、该研究通讯作者David Liu说道。
10.Nat Methods:开发出CRISPR辅助的新技术来检测活细胞中的RNA结合蛋白 未来有望助力人类疾病研究
doi:10.1038/s41592-020-0866-0
尽管目前科学家们还并未完全理解RNA分子的多样性,但他们认为,与这些RNA分子结合的RNA结合蛋白或与多种机体疾病的发生直接相关,近日,一项刊登在国际杂志Nature Methods上题为“CRISPR-assisted detection of RNA–protein interactions in living cells”的研究报告中,来自香港城市大学等机构的科学家们开发了一种名为CARPID的新型检测方法,其能识别活细胞中特殊RNAs的结合蛋白,这种新方法或能应用到多重类型的细胞研究领域,比如从识别癌症生物标志物到检测治疗多种病毒性疾病的潜在药物靶点等。
分子生物学的中心法则是DNA转录成为RNA,以及RNA最终翻译成为蛋白质,但实际上,只有大约2%的RNAs能够编码蛋白,而其余98%被称之为非编码RNAs(ncRNA)的RNA分子则由于其具有神秘的功能而被视为“暗物质”。近些年来,科学家们开始努力研究旨在揭开RNA的真实功能,尤其是长链非编码RNAs(lncRNA,长度仅有200多个核苷酸),lncRNA广泛被接受为能参与调节基因表达的重要细胞组分,同时其也是研究人员最感兴趣研究的RNA的一种。
11.Curr Gene Ther:基于ADAR的人工RNA编辑有望用于基因治疗
doi:10.2174/1566523220666200516170137
许多由点突变引起的疾病都没有现成的治疗方法。日本北陆先端科学技术大学院大学的Toshifumi Tsukahara教授及其同事们正在研究一种利用人工RNA编辑的治疗方法。人工定点RNA编辑是一种修改基因并最终调控蛋白功能的重要技术。Tsukahara团队正在尝试通过人工RNA编辑来修改转录物(RNA)的遗传密码,以治疗遗传性疾病。

图片来自Current Gene Therapy, 2020, doi:10.2174/1566523220666200516170137。
RNA编辑是一个生理过程,广泛存在于生物体内,可从单个基因中产生各种不同功能的蛋白。在哺乳动物中,RNA链中的碱基C或A可经碱基序列特异性水解后脱氨,从而使得C被U取代,A被I(肌苷)取代。鉴于I与C形成沃森-克里克(Watson-Crick)碱基对,因此在遗传密码上,I与G同义。这些碱基转换是由于A或C的脱氨而发生的,已经发现这是由ADAR和APOBEC家族酶催化的。最近,已经报道了各种利用ADAR进行人工RNA编辑的RNA修复技术。
在一篇近期发表在Current Gene Therapy期刊上的论文中,Tsukahara团队综述了应用ADAR恢复遗传密码的最新研究成果,以及在利用ADAR进行人工RNA编辑过程中涉及的不同方法。他们还谈到了ADAR各种异构体的比较研究。因此,他们将尝试对人工RNA编辑和ADAR的作用进行详细的概述,重点是酶促定点A→I编辑。
大多数的人工RNA编辑系统都是利用催化酶ADAR的活性位点和与靶标互补的向导RNA(gRNA)来招募活性位点到靶标RNA上。一种人工RNA编辑方法是使用化学方法。Vogel及其同事们采用SNAP标签将ADAR与gRNA连接起来,并报道该系统在体外和体内都是有效的。然而,这种技术需要持续供应效应物分子才能有效。据悉,它还可以利用RNA结合蛋白将gRNA与酶结合。两种源于噬菌体的拴系系统通常用于真核生物:Lambda N系统和MS2系统。利用ADAR酶与MS2系统可以实现遗传密码的恢复,在基因治疗方面具有前景。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


