Nat Commun:溶瘤病毒表达的I型干扰素会促进CAR-T细胞凋亡
来源:本站原创 2020-07-19 17:27
2020年7月19日讯/生物谷BIOON/---经基因改造后表达嵌合抗原受体(CAR)的T细胞在治疗血液恶性肿瘤方面取得了显著的成功。然而,在实体瘤的恶劣微环境中,多种免疫抑制机制限制了它们的渗透,并导致它们出现功能障碍。CAR-T细胞无法充分迁移到肿瘤中反映了一个不利的缺乏CXCL9、CXCL10和CXCL11的趋化因子梯度,其中CXCL9、CXCL10和
2020年7月19日讯/生物谷BIOON/---经基因改造后表达嵌合抗原受体(CAR)的T细胞在治疗血液恶性肿瘤方面取得了显著的成功。然而,在实体瘤的恶劣微环境中,多种免疫抑制机制限制了它们的渗透,并导致它们出现功能障碍。CAR-T细胞无法充分迁移到肿瘤中反映了一个不利的缺乏CXCL9、CXCL10和CXCL11的趋化因子梯度,其中CXCL9、CXCL10和CXCL11是表达CXCR32的活化T细胞的配体。CAR-T细胞在肿瘤微环境(TME)中的持续存在和功能未达最佳标准进一步源于(1)它们暴露于抑制性可溶性介质,如TGFβ、IL10和腺苷;(2)它们与诸如调节性T细胞、骨髓源性抑制细胞(MDSC)和肿瘤相关巨噬细胞之类的免疫抑制性细胞群体之间的相互作用;(3)它们结合促进T细胞功能衰竭和/或凋亡的抑制性配体。
溶瘤病毒(oncolytic virus, OV)是自然选择的或经过基因改造的病毒,优先在癌细胞中复制,但它们在正常健康细胞中的复制受到限制。溶瘤病毒启动靶向感染和肿瘤床裂解,同时在肿瘤环境中表达治疗性外源基因,如细胞因子、肿瘤抗原、免疫检查点抑制剂或T细胞衔接剂(T cell engager),以增强抗肿瘤免疫力。它们的核酸直接激活Toll样受体(TLR)和先天免疫反应途径,以启动促炎级联反应,从而刺激包括CXCL9、CXCL10、CXCL11和CCL5在内的趋化因子和细胞因子的产生,并改变抑制性免疫细胞和活化免疫细胞之间的平衡。通过这种方式,多种溶瘤病毒在临床前和临床试验中已被证明在给送它们后的不同时间点,可促进T细胞浸润、PD-L1上调,并让免疫学上冷的肿瘤变成热肿瘤。这些属性促使了在异种移植模型中评估溶瘤腺病毒与人CAR-T细胞的组合使用。
许多溶瘤病毒---特别是水泡性口炎病毒(VSV)---的肿瘤嗜性机制主要是由病毒对I型干扰素(IFN)的高度敏感性以及肿瘤细胞对I型IFN反应的同时丧失所介导。为了增加VSV的安全性、特异性和治疗指数,可将IFNβ编码在这种糖蛋白基因和聚合酶基因之间。此外,I型IFN可以作为一个关键的细胞因子信号,促进病毒和肿瘤反应性T细胞的激活。因此,VSVIFNβ(即表达IFNβ的VSV)的治疗价值在于它诱导溶癌作用(oncolysis)的能力,以及它重新参与免疫监视的能力。编码物种特异性IFNβ的VSV的临床前测试已导致这种平台最初在肝癌中如今在不同的适应症中进行临床评估,不论是作为单药治疗还是与免疫检查点抑制剂组合使用。
在一项新的研究中,来自美国梅奥诊所等研究机构的研究人员推测溶瘤病毒,尤其是VSVmIFNβ,具有激活促炎级联反应以改变肿瘤的细胞因子和趋化因子谱(chemokine profile)的内在特性,此外还具有经改造后可表达治疗性基因的可编程特性。这些特性将共同促进CAR-T细胞迁移到肿瘤中,并降低它们遭受的负调节。
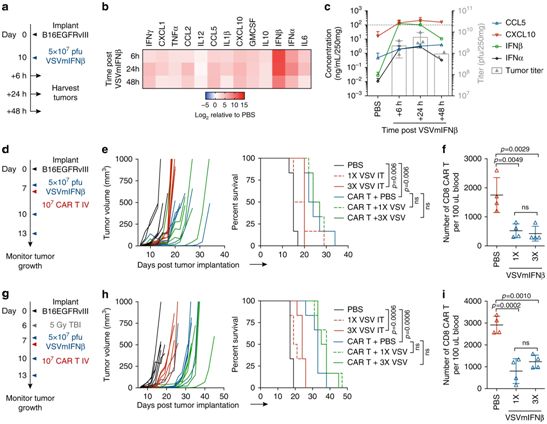
与这一假设相一致的是,VSV对肿瘤的感染产生了富含CXCL10和CCL5的趋化因子谱,据预测这将非常有利于招募过继转移性的CAR-T细胞。
然而,在利用EGFRvIII第三代CAR-T细胞治疗具有完全免疫能力的小鼠B16EGFRvIII肿瘤模型的过程中,他们发现了一个意想不到的拮抗机制,即VSVmIFNβ对肿瘤的感染与CAR-T细胞的严重受损相关。CAR-T细胞损失的大小与肿瘤中I型IFN的浓度成正比,而且在淋巴细胞剔除或自然杀伤细胞(NK)剔除的情况下,不表达I型IFN受体(IFNAR1)的CAR-T细胞对溶瘤病毒引起的这种损失大体上产生抵抗力。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Oncolytic virus-derived type I interferon restricts CAR T cell therapy”。
在这项新的研究中,这些研究人员发现不论是在体外还是在体内,I型IFN通过T细胞内在机制促进常规的和经过CAR修饰的T细胞凋亡。他们还报道了一种CAR-T细胞特异性机制,即I型IFN上调细胞表面上的CAR分子,促进抗原非依赖性激活,并驱动抑制性受体的表达。他们还证实IFNβ诱导的T细胞凋亡也发生于表达人CAR的T细胞和不表达CAR的T细胞中。
敲除IFNAR1基因的CAR-T细胞在体内优于表达IFNAR1的CAR-T细胞,并且在与VSVmIFNβ的组合使用下可改善对B16EGFRvIII肿瘤的治疗。
因此,这些数据显示,溶瘤病毒感染以对CAR-T细胞疗法既有益又有害的复杂方式重塑肿瘤微环境,并进一步强调,在具有完全免疫能力的模型中的经验性测试提供了关于这两种治疗平台之间相互作用的关键预测信息。这项研究揭示的这种种意想不到的治疗干扰机制,促使科学家们进一步研究CAR-T细胞与溶瘤病毒之间的相互作用,以便优化这种组合治疗。
这些研究结果还表明,溶瘤病毒诱导的炎症反应需要被理解为一种多组分现象,对抗肿瘤免疫反应的影响可能是正面的,也可能是负面的。与溶瘤病毒相关的I型IFN对CAR-T细胞的存活有负面影响,因此让CAR-T细胞对I型IFN不敏感有利于CAR-T细胞和溶瘤病毒的组合治疗。(生物谷 Bioon.com)
参考资料:
Laura Evgin et al. Oncolytic virus-derived type I interferon restricts CAR T cell therapy. Nature Communications, 2020, doi:10.1038/s41467-020-17011-z.
溶瘤病毒(oncolytic virus, OV)是自然选择的或经过基因改造的病毒,优先在癌细胞中复制,但它们在正常健康细胞中的复制受到限制。溶瘤病毒启动靶向感染和肿瘤床裂解,同时在肿瘤环境中表达治疗性外源基因,如细胞因子、肿瘤抗原、免疫检查点抑制剂或T细胞衔接剂(T cell engager),以增强抗肿瘤免疫力。它们的核酸直接激活Toll样受体(TLR)和先天免疫反应途径,以启动促炎级联反应,从而刺激包括CXCL9、CXCL10、CXCL11和CCL5在内的趋化因子和细胞因子的产生,并改变抑制性免疫细胞和活化免疫细胞之间的平衡。通过这种方式,多种溶瘤病毒在临床前和临床试验中已被证明在给送它们后的不同时间点,可促进T细胞浸润、PD-L1上调,并让免疫学上冷的肿瘤变成热肿瘤。这些属性促使了在异种移植模型中评估溶瘤腺病毒与人CAR-T细胞的组合使用。
许多溶瘤病毒---特别是水泡性口炎病毒(VSV)---的肿瘤嗜性机制主要是由病毒对I型干扰素(IFN)的高度敏感性以及肿瘤细胞对I型IFN反应的同时丧失所介导。为了增加VSV的安全性、特异性和治疗指数,可将IFNβ编码在这种糖蛋白基因和聚合酶基因之间。此外,I型IFN可以作为一个关键的细胞因子信号,促进病毒和肿瘤反应性T细胞的激活。因此,VSVIFNβ(即表达IFNβ的VSV)的治疗价值在于它诱导溶癌作用(oncolysis)的能力,以及它重新参与免疫监视的能力。编码物种特异性IFNβ的VSV的临床前测试已导致这种平台最初在肝癌中如今在不同的适应症中进行临床评估,不论是作为单药治疗还是与免疫检查点抑制剂组合使用。
在一项新的研究中,来自美国梅奥诊所等研究机构的研究人员推测溶瘤病毒,尤其是VSVmIFNβ,具有激活促炎级联反应以改变肿瘤的细胞因子和趋化因子谱(chemokine profile)的内在特性,此外还具有经改造后可表达治疗性基因的可编程特性。这些特性将共同促进CAR-T细胞迁移到肿瘤中,并降低它们遭受的负调节。
与这一假设相一致的是,VSV对肿瘤的感染产生了富含CXCL10和CCL5的趋化因子谱,据预测这将非常有利于招募过继转移性的CAR-T细胞。
然而,在利用EGFRvIII第三代CAR-T细胞治疗具有完全免疫能力的小鼠B16EGFRvIII肿瘤模型的过程中,他们发现了一个意想不到的拮抗机制,即VSVmIFNβ对肿瘤的感染与CAR-T细胞的严重受损相关。CAR-T细胞损失的大小与肿瘤中I型IFN的浓度成正比,而且在淋巴细胞剔除或自然杀伤细胞(NK)剔除的情况下,不表达I型IFN受体(IFNAR1)的CAR-T细胞对溶瘤病毒引起的这种损失大体上产生抵抗力。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Oncolytic virus-derived type I interferon restricts CAR T cell therapy”。

图片来自Nature Communications, 2020, doi:10.1038/s41467-020-17011-z。
在这项新的研究中,这些研究人员发现不论是在体外还是在体内,I型IFN通过T细胞内在机制促进常规的和经过CAR修饰的T细胞凋亡。他们还报道了一种CAR-T细胞特异性机制,即I型IFN上调细胞表面上的CAR分子,促进抗原非依赖性激活,并驱动抑制性受体的表达。他们还证实IFNβ诱导的T细胞凋亡也发生于表达人CAR的T细胞和不表达CAR的T细胞中。
敲除IFNAR1基因的CAR-T细胞在体内优于表达IFNAR1的CAR-T细胞,并且在与VSVmIFNβ的组合使用下可改善对B16EGFRvIII肿瘤的治疗。
因此,这些数据显示,溶瘤病毒感染以对CAR-T细胞疗法既有益又有害的复杂方式重塑肿瘤微环境,并进一步强调,在具有完全免疫能力的模型中的经验性测试提供了关于这两种治疗平台之间相互作用的关键预测信息。这项研究揭示的这种种意想不到的治疗干扰机制,促使科学家们进一步研究CAR-T细胞与溶瘤病毒之间的相互作用,以便优化这种组合治疗。
这些研究结果还表明,溶瘤病毒诱导的炎症反应需要被理解为一种多组分现象,对抗肿瘤免疫反应的影响可能是正面的,也可能是负面的。与溶瘤病毒相关的I型IFN对CAR-T细胞的存活有负面影响,因此让CAR-T细胞对I型IFN不敏感有利于CAR-T细胞和溶瘤病毒的组合治疗。(生物谷 Bioon.com)
参考资料:
Laura Evgin et al. Oncolytic virus-derived type I interferon restricts CAR T cell therapy. Nature Communications, 2020, doi:10.1038/s41467-020-17011-z.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


